(Created page with "==Resumo== ====Introdução==== A prevalência de disfunção neurogénica do baixo aparelho urinário (NLUTD) é desconhecida, mas a sua associação a lesão medular (LM)...") |
m (Scipediacontent moved page Draft Content 203960892 to Marialva et al 2015a) |
(No difference)
| |
Latest revision as of 11:30, 11 April 2017
Resumo
Introdução
A prevalência de disfunção neurogénica do baixo aparelho urinário (NLUTD) é desconhecida, mas a sua associação a lesão medular (LM) está bem estabelecida.
Objetivo
Verificar as alterações urodinâmicas e de qualidade de vida de doentes com NLUTD devida a LM submetidos a injeção de toxina botulínica do tipo A (BTX‐A).
Material e métodos
Estudo retrospetivo de 38 doentes submetidos a injeção intravesical de BTX‐A. Foram realizados estudos urodinâmicos previamente e 3‐6 meses após o tratamento. A qualidade de vida foi avaliada pelo questionário Qualiveen, aplicado a 20 pacientes. A análise estatística foi realizada com SPSS v22, com recurso ao teste correlação para amostras emparelhadas.
Resultados
A idade média foi de 38 anos (min = 23; máx = 63), sendo 63,2% homens. O nível mais frequente de lesão medular foi torácico (52,6%). O período médio decorrido entre a lesão e o primeiro tratamento com toxina botulínica foi de 92 meses (15‐240 meses). Em média os doentes foram submetidos a 3 tratamentos (min = 1; máx = 8), tendo ocorrido 3 episódios de efeitos secundários – hipoastenia ligeira e transitória. Obtivemos resultados urodinâmicos de 35 doentes que mostraram aumento da capacidade vesical (p = 0,24), aumento da compliance (p < 0,01) e diminuição da pressão máxima do detrusor (p < 0,01). Vinte doentes responderam ao questionário Qualiveen, com um resultado médio de um (resultado final possível 0‐4), mostrando um impacto positivo na qualidade de vida dos doentes.
Discussão/conclusão
O uso de BTX‐A para tratamento de NLUTD neste grupo de doentes é uma boa opção com excelentes resultados em termos urodinâmicos e de qualidade de vida.
Abstract
Introduction
The prevalence of neurogenic lower urinary tract disfunction (NLUTD) is unknown, but the risk of developing NLUTD associated with spinal cord injury (SCI) is high.
Objectives
Verify the changes of intradetrusor BTX‐A injection on urodynamic parameters and in the QoL of NLUTD patients due to SCI.
Material and methods
Retrospective study of 38 patients with SCI submitted to BTX‐A injection in our departments. Urodinamic studies were performed before and 3 to 6 months after treatment. QoL was evaluated by the Qualiveen questionnaire applied to 20 patients. Statistical analysis was performed with correlation tests for paired samples.
Results
Mean age was 38 years (Min = 23; Máx = 63), with 63.2% of males. The most frequent level of SCI was thoracic (52.6%). The average period between the SCI and the first treatment was 92 months (15 to 240 months). The patients had a mean of 3 treatments (min = 1;máx = 8), with 3 episodes of side effects ‐ transient and mild hypoasthenia. We collected data of urodynamic studies in 35 patients that showed increase in bladder capacity (p = 0,24) and compliance (p < 0,01) as well as a reduction in Pdetmax (p < 0.01). 20 patients answered the Qualiveen questionnaire with a mean result of 1 (possible final score 0‐4)
Discussion/Conclusion
The use of BTX‐A in our NLUTD patients is a treatment option with very good outcomes and important improvements in urodynamic parameters and in patients quality of life.
Palavras‐chave
Toxina botulínica ; Disfunção neurogénica vesical ; Lesão medular
Keywords
Botulinum toxin ; Urinary Bladder Neurogenic Dysfunction ; Spinal cord injuries
Introdução e objetivo
A função normal de armazenamento e esvaziamento do trato urinário inferior é coordenada por controlo neural entre o cérebro e a medula espinal. Qualquer interrupção neste sistema afetando a função vesical normal ou o fluxo de urina pode levar a sintomas de bexiga neurogénica ou disfunção neurogénica do trato urinário inferior (NLUTD)1 .
A NLUTD é uma doença crónica bem conhecida que afeta milhões de pessoas em todo o mundo e tem um importante impacto na qualidade de vida (QoL), aspetos emocionais, sociais, sexuais e ocupacionais.
Além das manifestações de incapacidade do doente, também acarreta um importante encargo económico em todos os sistemas de cuidados de saúde2 .
A prevalência global de NLUTD é desconhecida, mas o risco relativo de desenvolver NLUTD em combinação com outras patologias específicas é bem estabelecida, nomeadamente a sua associação com lesão da medular1 .
A lesão medular (LM), uma das causas mais frequentes de NLUTD em adultos jovens, é frequentemente associada com a hiperatividade neurogénica do detrusor (NDO)3 . Os pacientes podem ser assintomáticos e assim ficarem vulneráveis a várias complicações a longo prazo, sendo a mais importante o prejuízo da função renal. Este é secundário a altas pressões de armazenamento vesical, com ou sem refluxo vesicoureteral5 . As elevadas pressões de armazenamento vesical podem ser devidas à hiperatividade do detrusor, à baixa compliance vesical durante a fase de enchimento, bem como às contrações do detrusor contra um esfíncter contraído, conhecido como dissinergia vesico‐esfincteriana1 .
A instituição de cateterismo intermitente limpo e o uso de fármacos antimuscarínicos é a abordagem inicial recomendada.
A oxibutinina é o agente antimuscarínico mais usado em NDO e representa o tratamento goldstandard3 . Independentemente da sua eficácia, um dos principais problemas dos anticolinérgicos são os seus efeitos colaterais, nomeadamente secura de mucosas, obstipação ou visão turva4 . A adesão à terapêutica durante um longo período de tempo é baixa: 91% em 3 meses e 18% após um ano6 .
A toxina botulínica (BTX) surgiu como uma alternativa eficaz para pacientes com NDO que não toleram ou tiveram reduzida eficácia com medicamentos anticolinérgicos4 . A cirurgia de aumento da capacidade vesical, derivação urinária ou implante de neuroestimuladores de raízes sagradas são as hipóteses de recurso a considerar.
A primeira aplicação urológica, «off‐label» , de BTX‐A foi descrita por Dykstra et al., em 1988, que a injetou no esfíncter urinário externo para tratar dissinergia vesico‐esfincteriana em doentes com LM 1 ; 4 ; 7 . Em agosto de 2011, Botox® (onabotulinumtoxinA) recebeu a aprovação da FDA para a injeção intravesical no tratamento da incontinência urinária devida a NDO em adultos que têm uma resposta escassa ou são intolerantes a anticolinérgicos4 . Atualmente está aprovada em cerca de 75 países em todo o mundo, em particular para NDO secundária a esclerose múltipla e LM. Existe outra aplicação urológica deste composto, com aprovação pela FDA em janeiro de 2013, para doentes com bexiga hiperativa não neurogénica.
A BTX‐A bloqueia a libertação da acetilcolina na junção neuromuscular. O mecanismo de ação em NDO também pode reproduzir a sua ação em vias aferentes. Em modelo animal, a BTX‐A tem sido associada à redução da libertação de ATP pelo urotélio, secundária à distensão vesical. A inibição da libertação de acetilcolina e consequentemente de ATP pelo urotélio reduz o efeito excitatório em nervos aferentes suburoteliais e nos miofibroblastos durante a fase de armazenamento. As biópsias de pacientes tratados com BTX‐A revelaram a normalização dos recetores sensoriais nas fibras suburoteliais8 .
A administração de BTX‐A é uma técnica simples de realizar e habitualmente é bem tolerada pelos pacientes8 ; 9 . As injeções intravesicais de BTX podem ser feitas com cistoscópios rígidos ou flexíveis, sob anestesia local ou geral. Os vários protocolos de injeção que estão descritos divergem na dosagem, diluição e no número e localização dos locais de injecção8 . A injeção deve ser suavemente administrada no músculo detrusor. A penetração na parede vesical, trígono ou nos tecidos perivesicais deve se evitada2 . As reinjeções podem ser consideradas quando o efeito clínico do tratamento diminuir, o que acontece, em média, entre 3‐9 meses, mas não pode ser feito antes de completar 12 semanas após o primeiro tratamento8 .
Os eventos adversos associados a este tratamento são reduzidos. Eles podem ser separados em complicações locais ou sistémicas. As complicações locais incluem dor, infeção e hematúria, e estão geralmente relacionadas com o processo de administração e não com a toxina propriamente dita. O risco de aumento temporário do volume pós‐miccional ou de retenção urinária está bem documentado e, consequentemente, pode haver necessidade de cateterismo intermitente transitório. As complicações sistémicas ocorrem devido à difusão da toxina para além do detrusor e podem originar fraqueza muscular generalizada ou hipoastenia. No entanto, deve salientar‐se que a maioria dos casos de hipoastenia é transitória e ligeira. Não há relatos de adultos que necessitem de internamento hospitalar e há apenas alguns relatos de interferência significativa com a QoL do paciente1 .
Uma das principais metas para o tratamento de pacientes com NLUTD é a melhoria da sua QoL1 . Uma série de questionários foram estabelecidos para avaliar a QoL, na sua vertente global e específica da doença. O questionário Qualiveen foi desenvolvido em França especificamente para pacientes com bexiga neurogénica e avalia aspetos gerais e específicos relacionados com esta condição. Foi traduzido e validado para o idioma português em 20093 ; 10 .
Os principais objetivos deste estudo foram verificar as mudanças em parâmetros urodinâmicos e de QoL de doentes com NLUTD submetidos a injeção de BTX‐A intravesical.
Material e métodos
Nos 38 doentes com LM submetidos a tratamento com injeções intravesicais de BTX‐A, foi previamente feita instilação intravesical de solução de lidocaína (44 mL) em soro fisiológico (100 mL) e mantida durante 10 minutos. Em seguida dissolveram‐se 2 ampolas de 100 U de BTX‐A, diluídas com soro fisiológico até 15 mL, cada uma delas. Procedeu‐se a 30 injeções de 1 mL, ao longo da parede vesical, poupando o trígono, com uma agulha de 23 G com cistoscópio rígido.
Os critérios de inclusão foram: LM neurologicamente estável, baixa capacidade vesical (≤ 300 mL), hiperatividade do detrusor com incontinência e/ou infeções do trato urinário (ITU), sem resposta a medicação anticolinérgica ou com efeitos colaterais intoleráveis. Todos os pacientes que tiveram outros diagnósticos foram excluídos.
Os estudos urodinâmicos foram realizados antes e 3‐6 meses depois do tratamento, de acordo com as recomendações da Sociedade Internacional de Continência (ICS). Os parâmetros urodinâmicos foram definidos de acordo com a padronização da ICS.
A QoL foi avaliada pelo questionário Qualiveen aplicado a 20 doentes. Avalia o doente em 4 domínios – desconforto, limitações, medos e impacto na vida diária. Neste questionário a pontuação mais baixa possível é «0» e indica que os problemas urinários não têm impacto específico sobre QoL. O maior resultado possível é «4» e indica que os problemas urinários têm um enorme impacto sobre a QoL do participante.
A análise estatística dos resultados foi realizada através de correlação de Spearman para amostras emparelhadas com o software SPSS v22. Os intervalos de confiança foram definidos a 0,05.
Resultados
Obteve‐se uma amostra de 38 pacientes com LM e NLUTD com média de idade de 38 anos (mín = 23; máx = 63). Houve 63% (24) do sexo masculino e 37%14 do sexo feminino. A distribuição dos níveis de LM era (n): 29% (11) cervical, 53% (20) torácica e 18% (7) lombar. O período médio entre o aparecimento de LM e o primeiro tratamento com BTX foi de 92 meses (15‐240 meses).
Em média os pacientes realizaram 3 tratamentos (mín = 1; máx = 8) com BTX‐A e apenas foram detetados 3 episódios de efeitos secundários relacionados com a injeção BTX‐A nomeadamente diminuição da força muscular.
Obtiveram‐se os dados de estudos urodinâmicos de 35 pacientes, antes e depois do tratamento com BTX‐A, e os resultados mostram um aumento da capacidade vesical e um aumento significativo da compliance vesical, bem como uma redução importante na pressão máxima do detrusor ( tabela 1 ).
| Parâmetro | Antes de BTX‐A | Depois de BTX‐A | p | R |
|---|---|---|---|---|
| Capacidade vesical (mL) | 229,64 ± 116,97 | 317,88 ± 156,7 | 0,550 | 0,125 |
| Pdetmax (cmH2 O) | 56,36 ± 21,05 | 32,72 ± 19,23 | 0,038 | 0,631 |
| Compliance vesical (mL/cmH2 O) | 4,93 ± 3,71 | 14,21 ± 12,51 | 0,027 | 0,723 |
R: coeficiente de relação, correlação de Spearman.
Vinte pacientes responderam ao questionário Qualiveen e na nossa análise das respostas podemos inferir um efeito positivo da administração de BTX‐A na QoL dos pacientes (tabela 2 ).
| Domínios Qualiveen | Resultados (em média) |
|---|---|
| Limitações/inconveniência (itens 1‐9) | 1 |
| Constrangimentos/restrições (itens 10‐17) | 2 |
| Medos (itens 18‐25) | 1 |
| Sentimentos/impacto na vida diária (itens 26‐30) | 1 |
| Total score | 1 |
Discussão
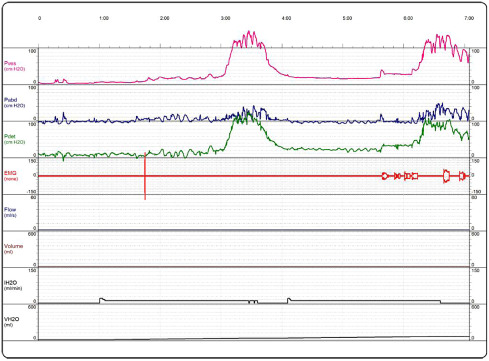
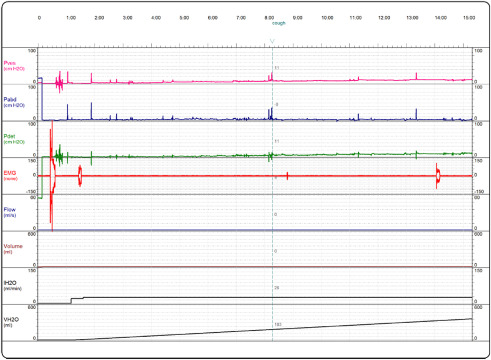
A injeção intravesical de BTX‐A é uma opção promissora para tratamento de NLUTD em pacientes com LM. Encontrámos importantes melhorias nos seus sintomas de incontinência e ITU, assim como nos parâmetros urodinâmicos avaliados (Figura 1 ; Figura 2 ). Na literatura, a primeira publicação apresentada por Schurch et al.11 , em 2000, focada no uso da BTX em 19 pacientes com LM com NDO, mostraram as mesmas melhorias nos mesmos parâmetros avaliados. Subsequentemente mais estudos relataram os benefícios deste tratamento reforçando a eficiência da BTX‐A no tratamento de NDO.
|
|
|
Figura 1. Exame urodinâmico de um doente com NLUTD antes do tratamento com BTX‐A.
|
|
|
|
Figura 2. Exame urodinâmico do mesmo paciente após o tratamento com BTX‐A.
|
No nosso estudo, os pacientes mantinham uma boa resposta terapêutica após a realização de diversos tratamentos, o que é um resultado promissor, considerando que a NLUTD é uma condição crónica e os pacientes têm uma expectativa de vida semelhante à da população em geral.
Na literatura, a incidência de efeitos adversos graves em pacientes submetidos a este tratamento é baixa e no nosso estudo com 38 pacientes só tivemos 3 casos de hipoastenia leve e transitória nestes doentes. Estes casos foram provavelmente devidos ao peso mais baixo destes pacientes tratados com as mesmas doses de BTX relativamente aos outros. Este efeito colateral foi relatado pela primeira vez por Wyndaele et al.12 , em 2002, que encontrou 2 casos de grave fraqueza muscular generalizada após a injeção de BTX. Uma revisão sistemática recente relatou que, de 1.025 pacientes que receberam este tratamento, a incidência de hipoastenia foi apenas de 5 casos (0,005%)13 .
Verificou‐se também que a melhoria, também em parâmetros urodinâmicos, resultou num efeito positivo sobre a QoL dos nossos pacientes. Mais recentemente, D‘Ancona et al.10 compararam os resultados dos estudos urodinâmicos com os dados do questionário Qualiveen aplicado ao seu grupo de pacientes e descobriram que a BTX‐A foi eficaz para todos os parâmetros por eles avaliados.
O nosso estudo relata apenas os dados do questionário Qualiveen após o último tratamento e, portanto, não podemos comparar com as respostas antes do tratamento. No entanto, sabemos que atualmente a maioria dos pacientes ficou satisfeita com o tratamento e informaram‐nos que previamente ao mesmo os seus problemas urinários afetavam gravemente a sua QoL. Devido a um impacto importante sobre a QoL, sugerimos usar o questionário Qualiveena todos os candidatos a este tratamento com BTX‐A, podendo avaliar de forma mais objetiva esta dimensão.
Conclusão
Em conclusão, o uso da BTX‐A para tratamento de NLUTD em doentes com LM é uma opção de tratamento a considerar com base nos bons resultados e melhorias importantes em parâmetros urodinâmicos e na QoL dos pacientes.
Responsabilidades éticas
Proteção de pessoas e animais
Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados
Os autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escrito
Os autores declaram que não aparecem dados de pacientes neste artigo.
Conflitos de interesses
Os autores declaram não haver conflito de interesses.
Bibliografia
- 1 A. Gulamhusein, A. Mangera; OnabotulinumtoxinA in the treatment of neurogenic bladder; Biologics (2012), p. 6
- 2 S. Knuepfer, K. Juenemann; Experience with botulinum toxin type A in the treatment of neurogenic detrusor overactivity in clinical practice; Ther Adv Urol, 6 (1) (2014), pp. 34–42
- 3 C. D‘Ancona, R. Ferreira, M. Rassi; Botulinum toxin in neurogenic detrusor overactivity; Int Neurol J, 16 (2012), pp. 139–143
- 4 T. Linsenmeyer; Use of botulinum toxin in individuals with neurogenic detrusor overactivity: State of the art review; J Spinal Cord Med (2013), p. 36
- 5 R. Gerridzen, A. Thijssen, E. Dehoux; Risk factors for upper tract deterioration in chronic spinal cord injury patients; J Urol, 147 (2) (1992), pp. 416–418
- 6 G. Kay, L. Granville; Antimuscarinic agents: Implications and concerns in the management of overactive bladder in the elderly; ClinTher, 27 (2005), pp. 127–138
- 7 D. Dykstra, A. Sidi, A. Scott, J. Pagel, G. Goldish; Effects of botulinum A toxin on detrusor‐sphincter dyssynergia in spinal cord injury patients; J Urol, 139 (5) (1988), pp. 919–922
- 8 J. Jayarajan, S.B. Radomski; Pharmacotherapy of overactive bladder in adults: A review of efficacy, tolerability, and quality of life; Res Rep Urol (2013), p. 6
- 9 P. Shenot, J. Mark; IntradetrusoronabotulinumtoxinA injection: How I do it; Can J Urol, 20 (1) (2013)
- 10 C. D‘Ancona, J. Tamanini, N. Botega, N. Lavoura, R. Ferreira, V. Leitão, et al.; Quality of life of neurogenic patients: Translation and validation of the Portuguese version of Qualiveen; Int Urol Nephrol, 41 (2009), pp. 29–33
- 11 B. Schurch, D. Schmid, M. Stohrer; Treatment of neurogenic incontinence with botulinum toxin A; N Engl J Med, 342 (9) (2000), p. 665
- 12 J. Wyndaele, S. van Dromme; Muscular weakness as side effect of botulinum toxin injection for neurogenic detrusor overactivity; Spinal Cord, 40 (11) (2002), pp. 599–600
- 13 A. Mangera, K. Andersson, A. Apostolidis, C. Chapple, P. Dasgupta, A. Giannantoni, et al.; Contemporary management of lower urinary tract disease with botulinum toxin A: A systematic review of Botox (onabotulinumtoxinA) and Dysport (abobotulinumtoxinA); Eur Urol, 60 (4) (2011), pp. 784–795
- 14 J. Pannek, B. Kullik; Does optimizing bladder management equal optimizing quality of life? Correlation between health‐related quality of life and urodynamic parameters in patients with spinal cord lesions; Urology, 74 (2) (2009), pp. 263–266
Document information
Published on 11/04/17
Licence: Other
Share this document
claim authorship
Are you one of the authors of this document?