(Tag: Visual edit) |
m (Libro.Blanco.AEMAC moved page Draft AEMAC 209287195 to Markaide Ruiz 2024a) |
||
| (3 intermediate revisions by the same user not shown) | |||
| Line 23: | Line 23: | ||
Las CANs pueden clasificarse aún más en dos grupos según su mecanismo de intercambio. En las CANs, el dinamismo de la red se logra aplicando un estímulo externo como calor, pH, luz, etc., a través de una vía disociativa o asociativa (ver Figura 1). | Las CANs pueden clasificarse aún más en dos grupos según su mecanismo de intercambio. En las CANs, el dinamismo de la red se logra aplicando un estímulo externo como calor, pH, luz, etc., a través de una vía disociativa o asociativa (ver Figura 1). | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image12-c.png|centre|600x600px]]</div> |
| − | + | ||
<div id="_heading=h.2et92p0" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div id="_heading=h.2et92p0" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 43: | Line 42: | ||
A altas temperaturas, la viscosidad de los vitrímeros está controlada por reacciones de intercambio químico, lo que produce una disminución térmica de la viscosidad que sigue la ley de Arrhenius, como se observa en materiales como el vidrio (Figura 2). Esta propiedad distingue a las CANs asociativas (vitrimeros) de las CANs disociativas y de los materiales termoplásticos porque estos materiales evolucionan de un estado sólido a un líquido de manera mucho más abrupta, siguiendo la ley de Williams-Landel-Ferry (WLF). | A altas temperaturas, la viscosidad de los vitrímeros está controlada por reacciones de intercambio químico, lo que produce una disminución térmica de la viscosidad que sigue la ley de Arrhenius, como se observa en materiales como el vidrio (Figura 2). Esta propiedad distingue a las CANs asociativas (vitrimeros) de las CANs disociativas y de los materiales termoplásticos porque estos materiales evolucionan de un estado sólido a un líquido de manera mucho más abrupta, siguiendo la ley de Williams-Landel-Ferry (WLF). | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image10-c.png|centre|600x600px]]</div> |
| − | + | ||
<div id="_heading=h.1t3h5sf" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div id="_heading=h.1t3h5sf" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 56: | Line 54: | ||
:2) Vitrímeros con una Tv < Tg : En este segundo caso, la reacción de intercambio intrínsecamente rápida está embebida en una matriz rígida con una Tg que es más alta que la Tv (Fig. 3b). En este caso, la Tv se puede calcular mediante la extrapolación de experimentos de relajación de esfuerzos o fluencia, esta transición es hipotética, ya que la red no queda congelada finalmente debido a la cinética de reacción, sino por la falta de movimiento de segmentos de cadena asociados con la Tg. A temperaturas por debajo de Tg, no ocurre ningún movimiento de segmentos de cadena y por lo tanto, no pueden ocurrir reacciones de intercambio y la red queda fija (cf. límite de difusión). Al calentar el material por encima de la temperatura de transición vítrea, el movimiento de diferentes segmentos de la cadena se inicia gradualmente mientras que las reacciones de intercambio ya son rápidas. En esta situación inicial, la cinética de reordenación/intercambio de la red está controlada por la difusión y los reordenamientos de la topología de la red están dominados por los movimientos de los diferentes segmentos de la cadena. En este caso el comportamiento de la viscosidad frente a la temperatura presenta un comportamiento que sigue la ley de WLF. Al seguir calentando el material, la cinética de intercambio cambian en cierto punto de un régimen controlado por difusión a un régimen controlado por la reacción de intercambio, que sigue la ley de Arrhenius. | :2) Vitrímeros con una Tv < Tg : En este segundo caso, la reacción de intercambio intrínsecamente rápida está embebida en una matriz rígida con una Tg que es más alta que la Tv (Fig. 3b). En este caso, la Tv se puede calcular mediante la extrapolación de experimentos de relajación de esfuerzos o fluencia, esta transición es hipotética, ya que la red no queda congelada finalmente debido a la cinética de reacción, sino por la falta de movimiento de segmentos de cadena asociados con la Tg. A temperaturas por debajo de Tg, no ocurre ningún movimiento de segmentos de cadena y por lo tanto, no pueden ocurrir reacciones de intercambio y la red queda fija (cf. límite de difusión). Al calentar el material por encima de la temperatura de transición vítrea, el movimiento de diferentes segmentos de la cadena se inicia gradualmente mientras que las reacciones de intercambio ya son rápidas. En esta situación inicial, la cinética de reordenación/intercambio de la red está controlada por la difusión y los reordenamientos de la topología de la red están dominados por los movimientos de los diferentes segmentos de la cadena. En este caso el comportamiento de la viscosidad frente a la temperatura presenta un comportamiento que sigue la ley de WLF. Al seguir calentando el material, la cinética de intercambio cambian en cierto punto de un régimen controlado por difusión a un régimen controlado por la reacción de intercambio, que sigue la ley de Arrhenius. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image14-c.png|centre|600x600px]]</div> |
| − | + | ||
<div id="_heading=h.4d34og8" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div id="_heading=h.4d34og8" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 65: | Line 62: | ||
Los vitrímeros se pueden obtener a través de diferentes rutas de síntesis en función del enlace dinámico empleado. En muchos casos es necesario el empleo de catalizadores con el fin de activar el dinamismo del enlace covalente dinámico. A continuación, se recogen las diferentes químicas empleadas (catalizadas y no catalizadas) para la obtención de vitrímeros. | Los vitrímeros se pueden obtener a través de diferentes rutas de síntesis en función del enlace dinámico empleado. En muchos casos es necesario el empleo de catalizadores con el fin de activar el dinamismo del enlace covalente dinámico. A continuación, se recogen las diferentes químicas empleadas (catalizadas y no catalizadas) para la obtención de vitrímeros. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image13-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 74: | Line 70: | ||
La reacción dinámica de transesterificación ocurre entre un éster y un alcohol para formar un nuevo éster y alcohol hasta que se alcanza el equilibrio, y esto generalmente requiere temperaturas elevadas y catalizadores como ácidos de Lewis o bases de Brønsted fuertes[49,50]. | La reacción dinámica de transesterificación ocurre entre un éster y un alcohol para formar un nuevo éster y alcohol hasta que se alcanza el equilibrio, y esto generalmente requiere temperaturas elevadas y catalizadores como ácidos de Lewis o bases de Brønsted fuertes[49,50]. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image6-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 88: | Line 83: | ||
Se trata de un tipo de vitrímeros que contienen un enlace dinámico intercambiable sin catalizador[41]. Los acilos vinílogos se forman mediante la reacción de condensación entre acetacetatos (uretano vinílogo) o acetamidas (urea viníloga) y monómeros de amina. | Se trata de un tipo de vitrímeros que contienen un enlace dinámico intercambiable sin catalizador[41]. Los acilos vinílogos se forman mediante la reacción de condensación entre acetacetatos (uretano vinílogo) o acetamidas (urea viníloga) y monómeros de amina. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image3-c.png|centre|600x600px]]</div> |
| − | + | ||
<div id="_heading=h.17dp8vu" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div id="_heading=h.17dp8vu" class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 97: | Line 91: | ||
La introducción de un enlace vinílico insertado entre el nitrógeno donador de electrones y un grupo aceptor de electrones confiere reactividad de tipo Michael con alta resistencia a la hidrólisis. La reacción de intercambio puede proceder sin catalizador a 100 °C o superior a través de la vía de adición de Michael. El ataque nucleofílico es realizado por un grupo de amina libre. Los tiempos de relajación disminuyen sustancialmente a medida que el grupo "X" se vuelve menos electronegativo (amida → uretano → urea). | La introducción de un enlace vinílico insertado entre el nitrógeno donador de electrones y un grupo aceptor de electrones confiere reactividad de tipo Michael con alta resistencia a la hidrólisis. La reacción de intercambio puede proceder sin catalizador a 100 °C o superior a través de la vía de adición de Michael. El ataque nucleofílico es realizado por un grupo de amina libre. Los tiempos de relajación disminuyen sustancialmente a medida que el grupo "X" se vuelve menos electronegativo (amida → uretano → urea). | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image5-c.png|centre|600x600px]]<span style="text-align: center; font-size: 75%;">''' '''</span></div> |
| − | <span style="text-align: center; font-size: 75%;">''' | + | |
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 111: | Line 104: | ||
La reacción de transcarbamoilación de grupos de carbamato en poliuretanos puede seguir diferentes vías, dependiendo de las unidades químicas involucradas: ''asociativa'' mediante el empleo de un catalizador, ''asociativa'' a mediante la adición nucleófila de grupos OH y ''disociativa''. La ruta disociativa es muy indeseable, ya que a menudo se asocia con reacciones secundarias indeseadas a altas temperaturas[24]. | La reacción de transcarbamoilación de grupos de carbamato en poliuretanos puede seguir diferentes vías, dependiendo de las unidades químicas involucradas: ''asociativa'' mediante el empleo de un catalizador, ''asociativa'' a mediante la adición nucleófila de grupos OH y ''disociativa''. La ruta disociativa es muy indeseable, ya que a menudo se asocia con reacciones secundarias indeseadas a altas temperaturas[24]. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image9-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 127: | Line 119: | ||
Estas redes poliiónicas se sintetizaron mediante un proceso de un solo paso a través de una poliadición de monómeros de α-azida-ω-alquino que implicaba una cicloadición Huisgen 1,3-dipolar (HAAC) de azida-alquino "sin clic" térmica y una reticulación simultánea con un agente de cuaternización de haluro de acilo. | Estas redes poliiónicas se sintetizaron mediante un proceso de un solo paso a través de una poliadición de monómeros de α-azida-ω-alquino que implicaba una cicloadición Huisgen 1,3-dipolar (HAAC) de azida-alquino "sin clic" térmica y una reticulación simultánea con un agente de cuaternización de haluro de acilo. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image7-c.png|centre|600x600px]]''' '''</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 149: | Line 140: | ||
El intercambio nucleófilo Si-O en siloxanos requiere de un iniciador aniónico o un catalizador básico. Las propiedades dinámicas de estas redes pueden ajustarse en función de la concentración del iniciador aniónico y de la densidad del reticulante[56–58]. | El intercambio nucleófilo Si-O en siloxanos requiere de un iniciador aniónico o un catalizador básico. Las propiedades dinámicas de estas redes pueden ajustarse en función de la concentración del iniciador aniónico y de la densidad del reticulante[56–58]. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image15-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 165: | Line 155: | ||
Guan y colaboradores demostraron las posibilidades de la reacción de metátesis de olefinas en redes de polibutadieno reticulado que contienen catalizador Grubbs de segunda generación[60–62] : | Guan y colaboradores demostraron las posibilidades de la reacción de metátesis de olefinas en redes de polibutadieno reticulado que contienen catalizador Grubbs de segunda generación[60–62] : | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image2-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 179: | Line 168: | ||
La esterificación de un ácido borónico con 1,2-diol o 1,3-diol conduce a la formación reversible de éster borónico en condiciones ambientales. | La esterificación de un ácido borónico con 1,2-diol o 1,3-diol conduce a la formación reversible de éster borónico en condiciones ambientales. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image1-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 207: | Line 195: | ||
El mecanismo de intercambio tiol-disulfuro implica el desplazamiento nucleofílico de un anión tiolato del disulfuro, mediante el ataque de otro anión tiolato[65–68]. | El mecanismo de intercambio tiol-disulfuro implica el desplazamiento nucleofílico de un anión tiolato del disulfuro, mediante el ataque de otro anión tiolato[65–68]. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image8-c.gif|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 223: | Line 210: | ||
El mecanismo de intercambio de disulfuro puede ocurrir por vía aniónica o radicalaria. En la vía aniónica, el ataque del anión tiolato al enlace disulfuro forma un nuevo enlace disulfuro y aniones tiolato a través de la escisión heterolítica del enlace S-S, donde el anión tiolato se genera en condiciones básicas o por adición de catalizadores (A)[70,71] . La vía radicalaria incluye la escisión homolítica del enlace S-S y la transferencia del radical y la reacción cruzada en respuesta a la luz (B)[72] o mediante la adición de un iniciador radical (C)[73]. La metátesis de disulfuro aromático en se ha estudiado ampliamente y se ha demostrado que funciona también a temperatura ambiente (D)[34,35,74–76]. | El mecanismo de intercambio de disulfuro puede ocurrir por vía aniónica o radicalaria. En la vía aniónica, el ataque del anión tiolato al enlace disulfuro forma un nuevo enlace disulfuro y aniones tiolato a través de la escisión heterolítica del enlace S-S, donde el anión tiolato se genera en condiciones básicas o por adición de catalizadores (A)[70,71] . La vía radicalaria incluye la escisión homolítica del enlace S-S y la transferencia del radical y la reacción cruzada en respuesta a la luz (B)[72] o mediante la adición de un iniciador radical (C)[73]. La metátesis de disulfuro aromático en se ha estudiado ampliamente y se ha demostrado que funciona también a temperatura ambiente (D)[34,35,74–76]. | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image4-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 234: | Line 220: | ||
A día de hoy, los disulfuros aromáticos son los enlaces dinámicos más prometedores para obtener materiales vitriméricos comerciales de alto rendimiento | A día de hoy, los disulfuros aromáticos son los enlaces dinámicos más prometedores para obtener materiales vitriméricos comerciales de alto rendimiento | ||
| − | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | + | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;">[[File:Draft_AEMAC_864475732-image11-c.png|centre|600x600px]]</div> |
| − | + | ||
<div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | <div class="center" style="width: auto; margin-left: auto; margin-right: auto;"> | ||
| Line 371: | Line 356: | ||
[32] Zhang, H.; Majumdar, S.; van Benthem, R.A.T.M.; Sijbesma, R.P.; Heuts, J.P.A. Intramolecularly Catalyzed Dynamic Polyester Networks Using Neighboring Carboxylic and Sulfonic Acid Groups. ''ACS Macro Lett'' '''2020''', ''9'', 272–277, doi:10.1021/acsmacrolett.9b01023. | [32] Zhang, H.; Majumdar, S.; van Benthem, R.A.T.M.; Sijbesma, R.P.; Heuts, J.P.A. Intramolecularly Catalyzed Dynamic Polyester Networks Using Neighboring Carboxylic and Sulfonic Acid Groups. ''ACS Macro Lett'' '''2020''', ''9'', 272–277, doi:10.1021/acsmacrolett.9b01023. | ||
| − | 33 | + | [33] Delahaye, M.; Tanini, F.; Holloway, J.O.; Winne, J.M.; Du Prez, F.E. Double Neighbouring Group Participation for Ultrafast Exchange in Phthalate Monoester Networks. ''Polym Chem'' '''2020''', ''11'', 5207–5215, doi:10.1039/D0PY00681E. |
| − | 34 | + | [34] Ruiz de Luzuriaga, A.; Martin, R.; Markaide, N.; Rekondo, A.; Cabanero, G.; Rodriguez, J.; Odriozola, I. Epoxy Resin with Exchangeable Disulfide Crosslinks to Obtain Reprocessable, Repairable and Recyclable Fiber-Reinforced Thermoset Composites. ''Mater Horiz'' '''2016''', ''3'', 241–247, doi:10.1039/c6mh00029k. |
| − | 35 | + | [35] Ruiz de Luzuriaga, A.; Martin, R.; Markaide, N.; Rekondo, A.; Cabanero, G.; Rodriguez, J.; Odriozola, I. Correction: Epoxy Resin with Exchangeable Disulfide Crosslinks to Obtain Reprocessable, Repairable and Recyclable Fiber-Reinforced Thermoset Composites. ''Mater Horiz'' '''2020''', ''7'', 2460–2461, doi:10.1039/d0mh90047h. |
| − | 36 | + | [36] Rowan, S.J.; Cantrill, S.J.; Cousins, G.R.L.; Sanders, J.K.M.; Stoddart, J.F. Dynamic Covalent Chemistry. ''Angewandte Chemie International Edition'' '''2002''', ''41'', 898–952, doi:10.1002/1521-3773(20020315)41:6<898::AID-ANIE898>3.0.CO;2-E. |
| − | 37 | + | [37] Wojtecki, R.J.; Meador, M.A.; Rowan, S.J. Using the Dynamic Bond to Access Macroscopically Responsive Structurally Dynamic Polymers. ''Nat Mater'' '''2011''', ''10'', 14–27, doi:10.1038/nmat2891. |
| − | 38 | + | [38] Roy, N.; Bruchmann, B.; Lehn, J.-M. DYNAMERS: Dynamic Polymers as Self-Healing Materials. ''Chem Soc Rev'' '''2015''', ''44'', 3786–3807, doi:10.1039/C5CS00194C. |
| − | 39 | + | [39] Maeda, T.; Otsuka, H.; Takahara, A. Dynamic Covalent Polymers: Reorganizable Polymers with Dynamic Covalent Bonds. ''Prog Polym Sci'' '''2009''', ''34'', 581–604, doi:10.1016/j.progpolymsci.2009.03.001. |
| − | 40 | + | [40] Chen, X.; Dam, M.A.; Ono, K.; Mal, A.; Shen, H.; Nutt, S.R.; Sheran, K.; Wudl, F. A Thermally Re-Mendable Cross-Linked Polymeric Material. ''Science (1979)'' '''2002''', ''295'', 1698–1702, doi:10.1126/science.1065879. |
| − | 41 | + | [41] Denissen, W.; Rivero, G.; Nicolaÿ, R.; Leibler, L.; Winne, J.M.; Du Prez, F.E. Vinylogous Urethane Vitrimers. ''Adv Funct Mater'' '''2015''', ''25'', 2451–2457, doi:10.1002/adfm.201404553. |
| − | 42 | + | [42] Bowman, C.N.; Kloxin, C.J. Covalent Adaptable Networks: Reversible Bond Structures Incorporated in Polymer Networks. ''Angewandte Chemie International Edition'' '''2012''', ''51'', 4272–4274, doi:10.1002/anie.201200708. |
| − | 43 | + | [43] Azcune, I.; Odriozola, I. Aromatic Disulfide Crosslinks in Polymer Systems: Self-Healing, Reprocessability, Recyclability and More. ''Eur Polym J'' '''2016''', ''84'', 147–160, doi:10.1016/j.eurpolymj.2016.09.023. |
| − | 44 | + | [44] Erice, A.; Ruiz de Luzuriaga, A.; Matxain, J.M.; Ruipérez, F.; Asua, J.M.; Grande, H.-J.; Rekondo, A. Reprocessable and Recyclable Crosslinked Poly(Urea-Urethane)s Based on Dynamic Amine/Urea Exchange. ''Polymer (Guildf)'' '''2018''', ''145'', 127–136, doi:10.1016/j.polymer.2018.04.076. |
| − | 45 | + | [45] Winne, J.M.; Leibler, L.; Du Prez, F.E. Dynamic Covalent Chemistry in Polymer Networks: A Mechanistic Perspective. ''Polym Chem'' '''2019''', ''10'', 6091–6108, doi:10.1039/C9PY01260E. |
| − | 46 | + | [46] Montarnal, D.; Capelot, M.; Tournilhac, F.; Leibler, L. Silica-Like Malleable Materials from Permanent Organic Networks. ''Science (1979)'' '''2011''', ''334'', 965–968, doi:10.1126/science.1212648. |
| − | 47 | + | [47] Denissen, W.; Winne, J.M.; Du Prez, F.E. Vitrimers: Permanent Organic Networks with Glass-like Fluidity. ''Chem Sci'' '''2016''', ''7'', 30–38, doi:10.1039/C5SC02223A. |
| − | 48 | + | [48] Krishnakumar, B.; Sanka, R.V.S.P.; Binder, W.H.; Parthasarthy, V.; Rana, S.; Karak, N. Vitrimers: Associative Dynamic Covalent Adaptive Networks in Thermoset Polymers. ''Chemical Engineering Journal'' '''2020''', ''385'', 123820, [doi:https://doi.org/10.1016/j.cej.2019.123820. doi:https://doi.org/10.1016/j.cej.2019.123820.] |
| − | 49 | + | [49] Self, J.L.; Dolinski, N.D.; Zayas, M.S.; Read de Alaniz, J.; Bates, C.M. Brønsted-Acid-Catalyzed Exchange in Polyester Dynamic Covalent Networks. ''ACS Macro Lett'' '''2018''', ''7'', 817–821, doi:10.1021/acsmacrolett.8b00370. |
| − | 50 | + | [50] Otera, Junzo. Transesterification. ''Chem Rev'' '''1993''', ''93'', 1449–1470, doi:10.1021/cr00020a004. |
| − | 51 | + | [51] Yu, K.; Taynton, P.; Zhang, W.; Dunn, M.L.; Qi, H.J. Reprocessing and Recycling of Thermosetting Polymers Based on Bond Exchange Reactions. ''RSC Adv.'' '''2014''', ''4'', 10108–10117, doi:10.1039/C3RA47438K. |
| − | 52 | + | [52] Obadia, M.M.; Mudraboyina, B.P.; Serghei, A.; Montarnal, D.; Drockenmuller, E. Reprocessing and Recycling of Highly Cross-Linked Ion-Conducting Networks through Transalkylation Exchanges of C–N Bonds. ''J Am Chem Soc'' '''2015''', ''137'', 6078–6083, doi:10.1021/jacs.5b02653. |
| − | 53 | + | [53] Kantor, S.W.; Grubb, W.T.; Osthoff, R.C. The Mechanism of the Acid- and Base-Catalyzed Equilibration of Siloxanes. ''J Am Chem Soc'' '''1954''', ''76'', 5190–5197, doi:10.1021/ja01649a076. |
| − | 54 | + | [54] Osthoff, R.C.; Bueche, A.M.; Grubb, W.T. Chemical Stress-Relaxation of Polydimethylsiloxane Elastomers <sup>1</sup>. ''J Am Chem Soc'' '''1954''', ''76'', 4659–4663, doi:10.1021/ja01647a052. |
| − | 55 | + | [55] Gilbert, A.R.; Kantor, S.W. Transient Catalysts for the Polymerization of Organosiloxanes. ''Journal of Polymer Science'' '''1959''', ''40'', 35–58, doi:10.1002/pol.1959.1204013603. |
| − | 56 | + | [56] Schmolke, W.; Perner, N.; Seiffert, S. Dynamically Cross-Linked Polydimethylsiloxane Networks with Ambient-Temperature Self-Healing. ''Macromolecules'' '''2015''', ''48'', 8781–8788, doi:10.1021/acs.macromol.5b01666. |
| − | 57 | + | [57] Wu, X.; Yang, X.; Yu, R.; Zhao, X.-J.; Zhang, Y.; Huang, W. A Facile Access to Stiff Epoxy Vitrimers with Excellent Mechanical Properties ''via'' Siloxane Equilibration. ''J Mater Chem A Mater'' '''2018''', ''6'', 10184–10188, doi:10.1039/C8TA02102C. |
| − | 58 | + | [58] Li, X.; Yu, R.; Zhao, T.; Zhang, Y.; Yang, X.; Zhao, X.; Huang, W. A Self-Healing Polysiloxane Elastomer Based on Siloxane Equilibration Synthesized through Amino-Ene Michael Addition Reaction. ''Eur Polym J'' '''2018''', ''108'', 399–405, doi:10.1016/j.eurpolymj.2018.09.021. |
| − | 59 | + | [59] Nishimura, Y.; Chung, J.; Muradyan, H.; Guan, Z. Silyl Ether as a Robust and Thermally Stable Dynamic Covalent Motif for Malleable Polymer Design. ''J Am Chem Soc'' '''2017''', ''139'', 14881–14884, doi:10.1021/jacs.7b08826. |
| − | 60 | + | [60] Scholl, M.; Ding, S.; Lee, C.W.; Grubbs, R.H. Synthesis and Activity of a New Generation of Ruthenium-Based Olefin Metathesis Catalysts Coordinated with 1,3-Dimesityl-4,5-Dihydroimidazol-2-Ylidene Ligands. ''Org Lett'' '''1999''', ''1'', 953–956, doi:10.1021/ol990909q. |
| − | 61 | + | [61] Lu, Y.-X.; Guan, Z. Olefin Metathesis for Effective Polymer Healing via Dynamic Exchange of Strong Carbon–Carbon Double Bonds. ''J Am Chem Soc'' '''2012''', ''134'', 14226–14231, doi:10.1021/ja306287s. |
| − | 62 | + | [62] Lu, Y.-X.; Tournilhac, F.; Leibler, L.; Guan, Z. Making Insoluble Polymer Networks Malleable via Olefin Metathesis. ''J Am Chem Soc'' '''2012''', ''134'', 8424–8427, doi:10.1021/ja303356z. |
| − | 63 | + | [63] Roy, D.; Cambre, J.N.; Sumerlin, B.S. Triply-Responsive Boronic Acid Block Copolymers: Solution Self-Assembly Induced by Changes in Temperature, PH, or Sugar Concentration. ''Chemical Communications'' '''2009''', 2106, doi:10.1039/b900374f. |
| − | 64 | + | [64] Fernandes, P.A.; Ramos, M.J. Theoretical Insights into the Mechanism for Thiol/Disulfide Exchange. ''Chemistry – A European Journal'' '''2004''', ''10'', 257–266, doi:10.1002/chem.200305343. |
| − | 65 | + | [65] Canadell, J.; Goossens, H.; Klumperman, B. Self-Healing Materials Based on Disulfide Links. ''Macromolecules'' '''2011''', ''44'', 2536–2541, doi:10.1021/ma2001492. |
| − | 66 | + | [66] An, S.Y.; Noh, S.M.; Nam, J.H.; Oh, J.K. Dual Sulfide–Disulfide Crosslinked Networks with Rapid and Room Temperature Self‐Healability. ''Macromol Rapid Commun'' '''2015''', ''36'', 1255–1260, doi:10.1002/marc.201500123. |
| − | 67 | + | [67] Pepels, M.; Filot, I.; Klumperman, B.; Goossens, H. Self-Healing Systems Based on Disulfide–Thiol Exchange Reactions. ''Polym Chem'' '''2013''', ''4'', 4955, doi:10.1039/c3py00087g. |
| − | 68 | + | [68] Gyarmati, B.; Némethy, Á.; Szilágyi, A. Reversible Disulphide Formation in Polymer Networks: A Versatile Functional Group from Synthesis to Applications. ''Eur Polym J'' '''2013''', ''49'', 1268–1286, doi:10.1016/j.eurpolymj.2013.03.001. |
| − | 69 | + | [69] Nevejans, S.; Ballard, N.; Miranda, J.I.; Reck, B.; Asua, J.M. The Underlying Mechanisms for Self-Healing of Poly(Disulfide)s. ''Physical Chemistry Chemical Physics'' '''2016''', ''18'', 27577–27583, doi:10.1039/C6CP04028D. |
| − | 70 | + | [70] Black, S.P.; Sanders, J.K.M.; Stefankiewicz, A.R. Disulfide Exchange: Exposing Supramolecular Reactivity through Dynamic Covalent Chemistry. ''Chem. Soc. Rev.'' '''2014''', ''43'', 1861–1872, doi:10.1039/C3CS60326A. |
| − | 71 | + | [71] García, F.; Smulders, M.M.J. Dynamic Covalent Polymers. ''J Polym Sci A Polym Chem'' '''2016''', ''54'', 3551–3577, doi:10.1002/pola.28260. |
| − | 72 | + | [72] Banchereau, E.; Lacombe, S.; Ollivier, J. Solution Reactivity of Thiyl Radicals with Molecular Oxygen: Unsensitized Photooxidation of Dimethyldisulfide. ''Tetrahedron Lett'' '''1995''', ''36'', 8197–8200, doi:10.1016/0040-4039(95)01698-H. |
| − | 73 | + | [73] Fairbanks, B.D.; Singh, S.P.; Bowman, C.N.; Anseth, K.S. Photodegradable, Photoadaptable Hydrogels via Radical-Mediated Disulfide Fragmentation Reaction. ''Macromolecules'' '''2011''', ''44'', 2444–2450, doi:10.1021/ma200202w. |
| − | 74 | + | [74] Ruiz de Luzuriaga, A.; Matxain, J.M.; Ruiperez, F.; Martin, R.; Asua, J.M.; Cabanero, G.; Odriozola, I. Transient Mechanochromism in Epoxy Vitrimer Composites Containing Aromatic Disulfide Crosslinks. ''Journal of Materials Chemistry C: Materials for Optical and Electronic Devices'' '''2016''', ''4'', 6220–6223, doi:10.1039/c6tc02383e. |
| − | 75 | + | [75] Ruiz de Luzuriaga, A.; Solera, G.; Azcarate-Ascasua, I.; Boucher, V.; Grande, H.-J.; Rekondo, A. Chemical Control of the Aromatic Disulfide Exchange Kinetics for Tailor-Made Epoxy Vitrimers. ''Polymer (Guildf)'' '''2022''', ''239'', 124457, doi:10.1016/j.polymer.2021.124457. |
[76] Rekondo, A.; Martin, R.; Ruiz de Luzuriaga, A.; Cabañero, G.; Grande, H.J.; Odriozola, I. Catalyst-Free Room-Temperature Self-Healing Elastomers Based on Aromatic Disulfide Metathesis. ''Mater. Horiz.'' '''2014''', ''1'', 237–240, doi:10.1039/C3MH00061C. | [76] Rekondo, A.; Martin, R.; Ruiz de Luzuriaga, A.; Cabañero, G.; Grande, H.J.; Odriozola, I. Catalyst-Free Room-Temperature Self-Healing Elastomers Based on Aromatic Disulfide Metathesis. ''Mater. Horiz.'' '''2014''', ''1'', 237–240, doi:10.1039/C3MH00061C. | ||
Latest revision as of 10:10, 15 October 2024
1 - INTRODUCCIÓN
La evolución en el diseño de materiales ha llevado al surgimiento de los vitrímeros, una clase única de polímeros con propiedades sorprendentes de autorreparación y reconfiguración. Estos materiales dinámicos representan una innovación significativa en la ingeniería de polímeros, ofreciendo versatilidad y funcionalidad inigualables.
Los plásticos pueden considerarse uno de los materiales clave y más empleados en los últimos 100 años[1]. Su versatilidad y adaptabilidad es incomparable a la de otro tipo de materiales, siendo maleables mediante métodos de procesado masivo como moldeo, extrusión y prensado en caliente[2] Los plásticos también son materiales duraderos, a menudo resistentes a la humedad, oxidación y biodegradación. Hay dos clases principales de plásticos: termoplásticos y termoestables. Los termoplásticos, pueden fundirse fácilmente y reprocesarse a temperatura elevada y pueden disolverse. Por otro lado, los termoestables no pueden reciclarse fácilmente después de su procesamiento inicial. Sin embargo, tienen una resistencia mecánica, estabilidad térmica y química significativamente mayores en comparación con los termoplásticos. Esta diferencia se puede entender al considerar sus estructuras químicas. Los termoplásticos comprenden cadenas poliméricas lineales que se asocian principalmente por fuerzas intermoleculares. A temperaturas más altas, estas fuerzas se superan y el plástico pasa de ser sólido a un líquido viscoelástico. En contraste, los termoestables comprenden redes tridimensionales (3D) con entrecruzamientos covalentes, que se forman durante el proceso de curado, de manera que todo el polímero puede considerarse una unidad molecular única[3]. Estos entrecruzamientos covalentes no se rompen fácilmente incluso a altas temperaturas, y el polímero generalmente se descompone antes de fundirse. Mientras que la mayoría de los plásticos no pueden degradarse fácilmente en sus monómeros correspondientes de manera rentable, los termoplásticos pueden reciclarse hasta cierto grado mediante procesamiento mecánico y disolución[4,5] . Lo mismo no se puede decir para los termoestables, que generalmente son adecuados solo para reutilizarse como materiales de relleno o como combustible[6]."
"Existe, por tanto, una motivación para desarrollar nuevos tipos de plásticos con resistencia y durabilidad similares a las de los termoestables, pero con capacidad de reprocesables, reparables y reciclables. Esto sería un habilitador clave en el desarrollo de una economía circular, donde los productos al final de su ciclo de vida podrían convertirse en la materia prima para otros materiales o reutilizarse de otras formas.
Un paso significativo hacia tales materiales es el desarrollo de Redes Covalentes Adaptativas (CANs, por sus siglas en inglés)[7–11] . Las CANs son materiales poliméricos con entrecruzamientos covalentes que se vuelven dinámicamente reversibles cuando se aplica un estímulo específico como calor, catalizador, luz o pH. En ausencia del estímulo correspondiente, su estructura entrecruzada puede dotarles de propiedades similares a los termoestables, como mayor resistencia y durabilidad. A diferencia de los termoestables tradicionales, que son esencialmente no reciclables, las CANs son, en principio, reciclables debido a la naturaleza dinámica de sus entrecruzamientos. Además, las CANs también pueden exhibir propiedades como maleabilidad, memoria de forma y autorreparación. En las últimas dos décadas, el campo de las CANs ha experimentado un gran avance, con una amplia gama de entrecruzamientos, polímeros y aplicaciones reportadas[12–16].En 2011, el grupo de Leibler reportó una nueva clase de CANs, a la que denominó vitrímeros, ya que su relación viscosidad-temperatura se asemeja a la de la sílice vitrea, siguiendo una dependencia tipo Arrhenius con la temperatura[17] . "Las CAN, pueden clasificarse aún más en dos grupos según su mecanismo de intercambio. El primer grupo de CANs utiliza un mecanismo de intercambio de enlaces cruzados disociativos. En este intercambio, los enlaces químicos primero se rompen y luego se vuelven a formar en otro lugar. Los enlaces dinámicos disociativos son aquellos que bajo un estímulo se rompen provocando una disminución de la densidad de reticulación en la red. (Fig. 1a). El segundo grupo de CANs utiliza intercambios de enlaces asociativos entre cadenas de polímeros, en los cuales el enlace cruzado original solo se rompe cuando se ha formado un nuevo enlace covalente en otra posición. En los enlaces dinámicos asociativos, , no hay una disminución de densidad de reticulación ya que en el momento que se rompe un enlace se forma otro. Los entrecruzamientos presentes en los vitrímeros son asociativos rompiéndose solo cuando se forman nuevos enlaces. [18–22]. Esto tiene dos efectos principales. En primer lugar, se puede observar una fase gomosa extendida cuando se calientan, en comparación con las CANs disociativas que cambian de un estado sólido a uno líquido de manera más abrupta[23] [23]. Sin embargo, la clasificación simplemente por el tipo de enlaces químicos puede ser engañosa, ya que ciertos enlaces químicos pueden operar mediante uno u otro mecanismo dependiendo de la condición específica. Por ejemplo, el enlace de carbamato experimenta transcarbometilación asociativa en presencia de grupos hidroxilo en exceso[24] [26], mientras que el mecanismo de reversión de uretano disociativo es predominante en ausencia de esos grupos[25] [27]. Además, el mecanismo de estos materiales también puede no ser fácilmente dilucidado simplemente observando sus propiedades físicas; en algunos casos, los materiales que operan a través del mecanismo disociativo pueden tener propiedades reológicas indistinguibles de los vitrímeros [23–28]. Esto ocurre cuando la constante de velocidad de formación de enlaces es significativamente mayor que la de ruptura de enlaces, de manera que la proporción de enlaces disociados es pequeña. Como resultado, la dependencia viscosidad-temperatura de estos materiales todavía sigue la ley de Arrhenius, y estos materiales todavía pueden considerarse materiales tipo vitrímero (Fig. 1.1)[26]. Además, en materiales reales, las redes poliméricas están entrecruzadas no solo a través de enlaces covalentes, sino también mediante interacciones intramoleculares, como interacciones de Van der Waals, interacciones de enlace de hidrógeno y coordinación metal-ligando. Estas interacciones físicas respaldan las propiedades mecánicas de los materiales junto con los enlaces químicos en la red. En esta revisión, nuestro enfoque estará tanto en los vitrímeros como en los materiales con propiedades vitrímeras.
Desde los primeros vitrímeros descritos por Leibler, el número de polímeros vitrímeros en la literatura ha aumentado enormemente. Se ha demostrado que numerosos enlaces químicos reversibles, como aquellos basados en reacciones de adición-eliminación, reacciones de adición-eliminación conjugada, transalquilación e incluso intercambios de heteroátomos como boronatos y siloxanos, son efectivos como entrecruzamientos en materiales vitrímeros. Dentro de cada tipo de enlace químico, también se han explorado diferentes sistemas catalíticos y estructuras poliméricas. Más recientemente, se han desarrollado estrategias como el uso de catalizadores unidos covalentemente[29], catálisis por grupos vecinos [30–33] e incluso reacciones sin catalizadores[34,35]para hacer estos materiales más reprocesables. Los materiales vitrímeros también se han explorado en numerosas aplicaciones. Para hacer frente a los desafíos ambientales, se ha demostrado la capacidad de reprocesamiento y reciclabilidad de los vitrímeros. Además, varios grupos también han informado sobre aplicaciones como materiales auto-reparables, adhesivos reutilizables, materiales con memoria de forma e incluso en impresión en 3D. Los vitrímeros también se han combinado con nanomateriales para formar compuestos con propiedades sinérgicas.
En esta revisión, nuestro objetivo es resumir de manera integral los desarrollos recientes en materiales vitrímeros, prestando especial atención a los principios de diseño detrás de ellos, así como a sus aplicaciones emergentes en diversos campos (Fig. 1.2).
2 - CARACTERÍSTICAS Y COMPORTAMIENTO DE VITRÍMEROS Y CANS
En los últimos años, ha habido gran interés en un área de la química donde el enlace covalente tiene la capacidad de formarse, romperse e incluso reformarse reversiblemente[36]. Ejemplos de funcionalidades covalentes potencialmente dinámicas incluyen acetales, anhídridos borazaromáticos, ésteres de borato, disulfuros, hidrazonas, iminas, oximas y olefinas (metatesis) entre otras. La formación de la mayoría de estos grupos funcionales requiere un catalizador para iniciar y/o acelerar el equilibrio. El tipo de catalizador depende de la naturaleza del enlace covalente que se requiere hacer dinámico. Incluso los enlaces covalentes estables, como los éteres y amidas, pueden hacerse reversibles. Sin embargo, los catalizadores y condiciones necesarios para establecer los equilibrios suelen ser demasiado agresivos para tolerar la presencia de otras funcionalidades en la molécula. En esta revisión, analizaremos los enlaces covalentes dinámicos que tienen el potencial de hacerse reversibles bajo condiciones relativamente suaves.
Las redes covalentes adaptables (CANs, por sus siglas en inglés) son aquellas redes que contienen un número suficiente y una topología de enlaces covalentes reversibles que permiten que la estructura de red reticulada responda químicamente a un estímulo aplicado. Esta respuesta, que generalmente es un cambio en el estrés y/o forma (deformación) del material, se logra sin necesidad de degradación irreversible de la estructura de la red, siendo capaz de mantener la densidad de enlaces inicial mientras permite que el material se reorganice. Las CANs son materiales 'inteligentes' capaces de responder a un estímulo externo con un cambio en la estructura física de la red.
El diseño de materiales poliméricos que combinan las ventajas de los polímeros termoestables con las propiedades de flujo de los materiales termoplásticos se ha convertido en un campo de gran interés. En este sentido, los enfoques recientes buscan convertir los polímeros termoestables en materiales dinámicos utilizando enlaces covalentes dinámicos en la red para habilitar características funcionales como autorreparación, reciclabilidad, reparación, reprocesado, memoria de forma y adaptabilidad[11,37–39]. La introducción de enlaces covalentes dinámicos en cada punto de entrecruzamiento conduce a la obtención de una red covalente adaptable (CAN), un nuevo concepto introducido en la química de polímeros por Bowman y otros[11,27,40–44].
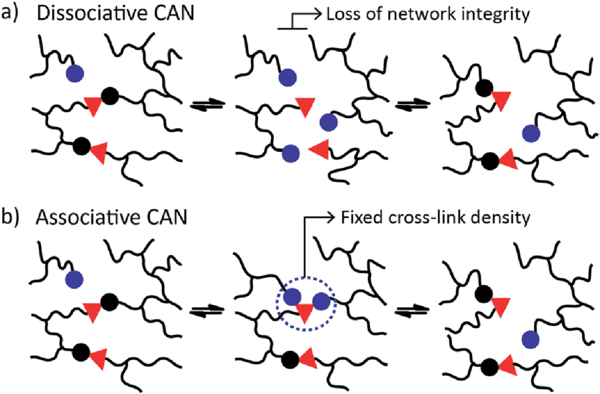
Las CANs pueden clasificarse aún más en dos grupos según su mecanismo de intercambio. En las CANs, el dinamismo de la red se logra aplicando un estímulo externo como calor, pH, luz, etc., a través de una vía disociativa o asociativa (ver Figura 1).
2.1 - CANs DISOCIATIVAS
El primer grupo de CANs hace uso de un mecanismo de intercambio de entrecruzamiento disociativo. En este intercambio, los enlaces químicos primero se rompen y luego se forman nuevamente en otro lugar. Los enlaces disociativos se basan en un desplazamiento desencadenado del equilibrio de asociación hacia el estado disociado endotérmico, transformando la red polimérica en un material similar a un termoplástico. Este mecanismo conduce a una caída repentina de la viscosidad que permite un reprocesamiento rápido, pero también una deformación no controlada a altas temperaturas y una peor resistencia a los solventes.
El enlace disociativo más estudiado es la reacción de Diels-Alder reversible entre furanos y maleimidas en redes poliméricas orgánicas. Los enlaces disociativos se rompen para volver a formarse más tarde en otro punto. Al calentar estos materiales, se produce una disminución de los puntos de reticulación debido a la disociación de los enlaces dinámicos porque el equilibrio químico se desplaza hacia el lado endotérmico. Por lo tanto, estos materiales pueden lograr una relajación muy rápida del estrés debido a una disminución en la conectividad. Esta pérdida a corto plazo de entrecruzamientos resulta en una caída repentina de la viscosidad, similar al comportamiento observado en polímeros termoplásticos. Al enfriar el material, los entrecruzamientos se forman nuevamente, en la misma medida que en el material inicial, recuperando las deseables propiedades termoestables como rigidez e insolubilidad. Sin embargo, debido a las temperaturas bastante suaves requeridas para la disociación de enlaces, estas CANs disociativas no pueden utilizarse en aplicaciones donde se requieran propiedades térmicas y mecánicas elevadas.
2.2 - CANs ASOCIATIVAS
El segundo grupo de CANs contiene enlaces dinámicos asociativos entre cadenas poliméricas, en los que el entrecruzamiento original solo se rompe cuando se ha formado un nuevo enlace covalente en otra posición. Los enlaces asociativos mantienen una densidad de entrecruzamiento constante porque se necesita formar un nuevo enlace covalente ya sea simultáneamente o antes de romper un enlace covalente existente[45]. Leibler y sus colaboradores[46] fueron los primeros en introducir este tipo de enlaces covalentes asociativos en resinas epoxi para obtener una red epoxi reparable basada en un mecanismo de transesterificación catalizada por zinc, que demostró experimentar reordenamientos topológicos graduales al calentarse. Los intercambios dinámicos observados se asemejan al comportamiento de la sílice vítrea y esta nueva generación de materiales CAN se la denominó como Vitrímeros[47].
Los vitrímeros se comportan como materiales entrecruzados a temperaturas por debajo de la Tg, y como líquidos viscoelásticos a altas temperaturas. La presencia de enlaces dinámicos facilita el reprocesado de la red y el reciclaje a pesar de tratarse de materiales reticulados.
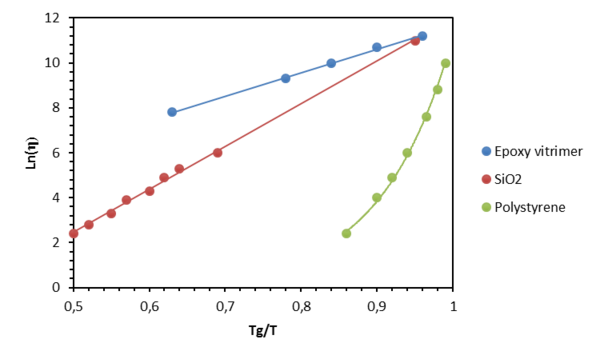
El proceso de reordenamiento de los vitrímeros puede ser controlado por dos temperaturas de transición distintas: la temperatura de transición vítrea (Tg) y la temperatura de congelación topológica (Tv). Tv representa la temperatura por debajo de la cual el intercambio químico se vuelve despreciable. Se define teóricamente como la temperatura en la que la viscosidad alcanza los 1012 Pa·s[43].
A altas temperaturas, la viscosidad de los vitrímeros está controlada por reacciones de intercambio químico, lo que produce una disminución térmica de la viscosidad que sigue la ley de Arrhenius, como se observa en materiales como el vidrio (Figura 2). Esta propiedad distingue a las CANs asociativas (vitrimeros) de las CANs disociativas y de los materiales termoplásticos porque estos materiales evolucionan de un estado sólido a un líquido de manera mucho más abrupta, siguiendo la ley de Williams-Landel-Ferry (WLF).
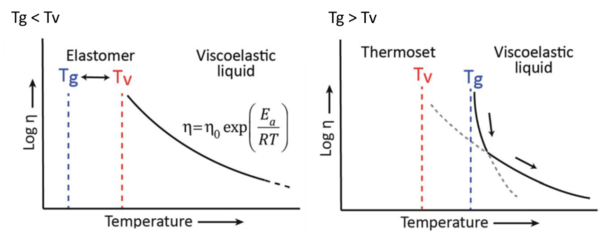
En los vitrímeros se pueden distinguir dos casos en función de la Tg y la Tv:
- 1) Vitrímeros con una Tg < Tv: En este primer caso al calentar el material desde una temperatura inferior a Tg hasta una temperatura entre Tg y Tv, el sólido vítreo primero experimentará una transición a un estado gomoso comportándose como un elastómero, ya que la reacción de intercambio es tan lenta que la estructura de la red está prácticamente fija. Solo al continuar calentando el material, la reacción de intercambio se acelera y se vuelve relevante a temperaturas superiores a Tv, transformando el elastómero en un líquido viscoelástico cuyo flujo está principalmente controlado por la cinética de intercambio de los puntos de reticulación, produciéndose una bajada de la viscosidad con la temperatura que sigue la ley de Arrhenius.
- 2) Vitrímeros con una Tv < Tg : En este segundo caso, la reacción de intercambio intrínsecamente rápida está embebida en una matriz rígida con una Tg que es más alta que la Tv (Fig. 3b). En este caso, la Tv se puede calcular mediante la extrapolación de experimentos de relajación de esfuerzos o fluencia, esta transición es hipotética, ya que la red no queda congelada finalmente debido a la cinética de reacción, sino por la falta de movimiento de segmentos de cadena asociados con la Tg. A temperaturas por debajo de Tg, no ocurre ningún movimiento de segmentos de cadena y por lo tanto, no pueden ocurrir reacciones de intercambio y la red queda fija (cf. límite de difusión). Al calentar el material por encima de la temperatura de transición vítrea, el movimiento de diferentes segmentos de la cadena se inicia gradualmente mientras que las reacciones de intercambio ya son rápidas. En esta situación inicial, la cinética de reordenación/intercambio de la red está controlada por la difusión y los reordenamientos de la topología de la red están dominados por los movimientos de los diferentes segmentos de la cadena. En este caso el comportamiento de la viscosidad frente a la temperatura presenta un comportamiento que sigue la ley de WLF. Al seguir calentando el material, la cinética de intercambio cambian en cierto punto de un régimen controlado por difusión a un régimen controlado por la reacción de intercambio, que sigue la ley de Arrhenius.
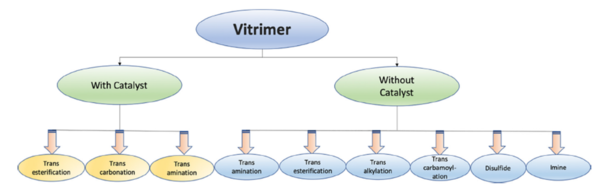
3 - CLASIFICACIÓN DE LOS VITRÍMEROS
Los vitrímeros se pueden obtener a través de diferentes rutas de síntesis en función del enlace dinámico empleado. En muchos casos es necesario el empleo de catalizadores con el fin de activar el dinamismo del enlace covalente dinámico. A continuación, se recogen las diferentes químicas empleadas (catalizadas y no catalizadas) para la obtención de vitrímeros.
3.1 - TRANSESTERIFICACIÓN
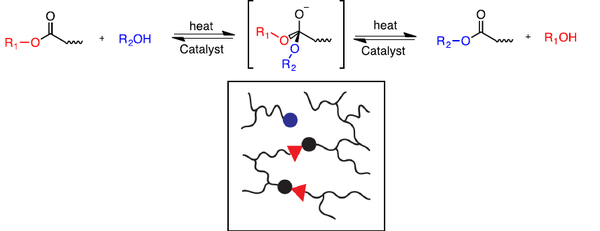
La reacción dinámica de transesterificación ocurre entre un éster y un alcohol para formar un nuevo éster y alcohol hasta que se alcanza el equilibrio, y esto generalmente requiere temperaturas elevadas y catalizadores como ácidos de Lewis o bases de Brønsted fuertes[49,50].
En 2011, Leibler y colaboradores demostraron el concepto de vitrímeros utilizando reacciones de transesterificación basadas en ácido carboxílico, promovidas por un catalizador de zinc. De sesta manera se abrió las puertas a la química de vitrímeros[46]. La velocidad de la reacción de transesterificación catalizada a temperatura ambiente es insignificante. Por lo tanto, las redes típicas de epoxi/ácido se comportan como resinas de epoxi convencionales por debajo de Tg. Sin embargo, al calentarse, las rápidas reacciones de intercambio permiten la reorganización de la estructura de la red, lo que permite deformar, procesar y reciclar el material[51]. La cinética de la reacción de intercambio puede controlarse fácilmente con el tipo y la concentración del catalizador. Al cambiar la cantidad y naturaleza del catalizador, la energía de activación y la Tv pueden ajustarse con una perturbación mínima de las propiedades del material.
- Ventajas: Alta capacidad de reprocesado, alta estabilidad térmica, insoluble, disponibilidad de monómeros comerciales, fácil síntesis.
- Desventajas: Baja solubilidad de los catalizadores, migración del catalizador, hidrólisis de los grupos éster, baja solubilidad de los ácidos carboxílicos en la resina epoxi. La estabilidad a largo plazo se puede ver empeorado debido a la pérdida del catalizador y hidrólisis de los grupos éster.
3.1.2 Transaminación de acilos vinílogos
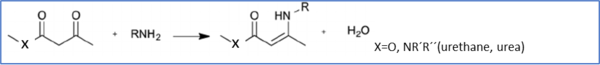
Se trata de un tipo de vitrímeros que contienen un enlace dinámico intercambiable sin catalizador[41]. Los acilos vinílogos se forman mediante la reacción de condensación entre acetacetatos (uretano vinílogo) o acetamidas (urea viníloga) y monómeros de amina.
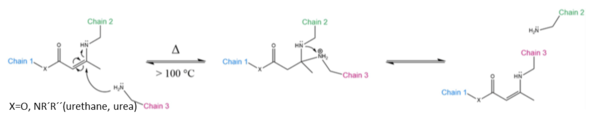
La introducción de un enlace vinílico insertado entre el nitrógeno donador de electrones y un grupo aceptor de electrones confiere reactividad de tipo Michael con alta resistencia a la hidrólisis. La reacción de intercambio puede proceder sin catalizador a 100 °C o superior a través de la vía de adición de Michael. El ataque nucleofílico es realizado por un grupo de amina libre. Los tiempos de relajación disminuyen sustancialmente a medida que el grupo "X" se vuelve menos electronegativo (amida → uretano → urea).
Empleando un exceso de amina en la síntesis de estos materiales, se pueden obtener vitrímeros con suficientes aminas libres en la red polimérica dando lugar a materiales con alta velocidad de intercambio de enlaces. Además, los materiales resultantes mostraron buenas propiedades mecánicas, similares a las de los vitrímeros de epoxi/ácido pero con tiempos de relajación mucho más cortos (3 minutos a 150 °C). Esto puede atribuirse a la alta densidad de uretanos vinílogos en la red, y a la baja energía de activación de este tipo de materiales de 60 kJ· mol-1.
- Ventajas: Materiales estables frente a la hidrólisis. No se necesitan catalizadores. Buenas propiedades mecánicas.
- Desventajas: Liberación de agua en la síntesis, química más compleja y se requiere de amplios conocimientos en química en la preparación de los materiales.
3.3 - TRANSCARBAMOILACIÓN
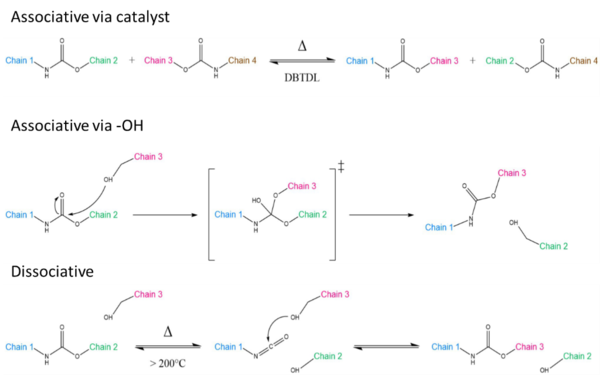
La reacción de transcarbamoilación de grupos de carbamato en poliuretanos puede seguir diferentes vías, dependiendo de las unidades químicas involucradas: asociativa mediante el empleo de un catalizador, asociativa a mediante la adición nucleófila de grupos OH y disociativa. La ruta disociativa es muy indeseable, ya que a menudo se asocia con reacciones secundarias indeseadas a altas temperaturas[24].
La transcarbamoilación es una reacción de intercambio bastante lenta y presenta varios desafíos debido a una alta energía de activación. Por eso se requieren altas temperaturas para activar el dinamismo produciéndose reacciones secundarias que conducen a la degradación de los materiales. Por lo tanto, la aplicabilidad de la transcarbamoilación para poliuretanos reprocesables sigue siendo un desafío para su aplicación en materiales comerciales.
- Ventajas: Disponibilidad de los monómeros. Síntesis fácil y bien conocida por la industria.
- Desventajas: Reacciones de intercambio lentas. Degradación. Materiales de con cinéticas de intercambio lentas.
3.4 - TRANSALQUILACIÓN
Los vitrímeros basados en el mecanismo de transalquilación fueron empleados en el diseño de vitrímeros conductores de iones que pueden conducir la electricidad por encima de la Tg. Este tipo de vitrímeros fueron descritos por primera vez por Drockenmuller y colaboradores en 2015[52].
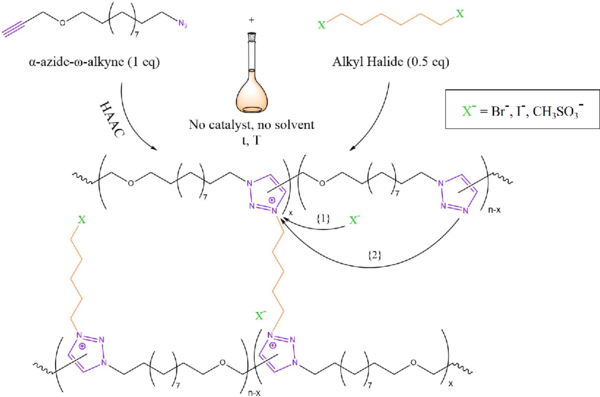
Estas redes poliiónicas se sintetizaron mediante un proceso de un solo paso a través de una poliadición de monómeros de α-azida-ω-alquino que implicaba una cicloadición Huisgen 1,3-dipolar (HAAC) de azida-alquino "sin clic" térmica y una reticulación simultánea con un agente de cuaternización de haluro de acilo.
En este tipo de vitrímeros las reacciones de intercambio pueden ocurrir por dos vías diferentes:
(1) Ataque nucleofílico del contraión sobre la especie alquil-triazolio produciéndose una bajada en la densidad de reticulación temporal.
(2) Adición nucleofílica concertada de tipo SN2 mediada por una unidad de triazol libre.
Los tiempos de relajación de los polímeros obtenidos oscilaron entre 30 min a 130 °C y unos pocos segundos a 200 °C. Las propiedades de fluidez de estos sistemas pueden controlarse mediante la elección del contraiónu (Br- >> I- > MsO-).
- Ventajas: Los polímeros iónicos presentan propiedades interesantes de conductividad, modulable en función de la funcionalización. Materiales interesantes para aplicacioes como polielectrolitos en membranas para captura de CO2, pilas de combustible, supercapacitodores y baterías entre otros.
- Desventajas: Problemas de escalado y coste. Se ha observado pérdida de propiedades tras el reprocesado muy probablemente debido a reacciones secundarias indeseadas y ruptura de cadena.
3.5 -INTERCAMBIO Si-O en Siloxanos y Silil ÉTERES
El equilibrio dinámico de los siloxanos y su uso en la relajación química de tensiones del elastómero de polidimetilsiloxano (PDMS) ya se sugirieron en la década de 1950[53–55].
El intercambio nucleófilo Si-O en siloxanos requiere de un iniciador aniónico o un catalizador básico. Las propiedades dinámicas de estas redes pueden ajustarse en función de la concentración del iniciador aniónico y de la densidad del reticulante[56–58].
El intercambio de enlaces Si-O también puede utilizarse en materiales a base de éter de sililo[59].
- Ventajas: Fácil modulación de las propiedades dinámicas en función de la concentración del iniciador aniónico y la densidad del reticulante.
- Desventajas: La degradación térmica parece ser un problema importante en los sistemas conocidos.
3.6 - METÁSTESIS DE OLEFINAS
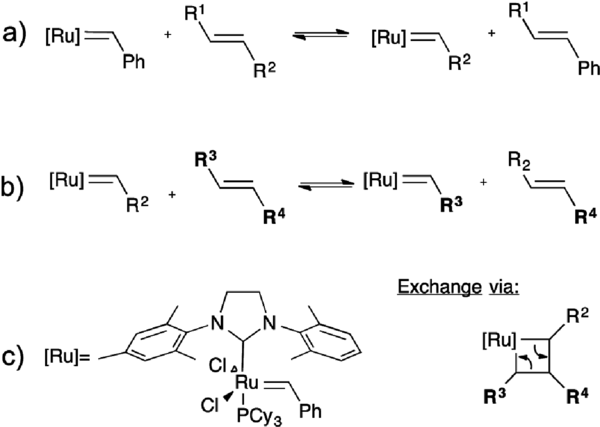
La mayoría de los enlaces covalentes dinámicos utilizados para diseñar vitrímeros implican heteroátomos en reacciones dinámicas de intercambio. La formación reversible de enlaces carbono-carbono resulta especialmente atractiva para este tipo de aplicaciones, ya que la gran estabilidad de los enlaces C-C puede ofrecer la posibilidad de diseñar polímeros dinámicos más resistentes.
Guan y colaboradores demostraron las posibilidades de la reacción de metátesis de olefinas en redes de polibutadieno reticulado que contienen catalizador Grubbs de segunda generación[60–62] :
El catalizador Grubbs de 2ª generación no es compatible con estas condiciones de reticulación, por lo que fue necesario introducir el catalizador mediante un experimento de hinchamiento.
- Ventajas: Buen enfoque para desarrollar elastómeros autoreparantes. Alta eficacia y eficiencia de reparación mediante la formación dinámica de enlaces covalentes a temperaturas por debajo de la temperatura ambiente.
- Desventajas: No es fácil de aplicar en vitrímeros rígidos.
3.7 - REACCIONES DE INTERCAMBIO DE ÉSTERES BORÓNICOS
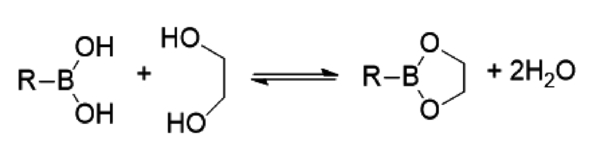
La esterificación de un ácido borónico con 1,2-diol o 1,3-diol conduce a la formación reversible de éster borónico en condiciones ambientales.
En medios acuosos, el equilibrio se favorece hacia los ésteres de boronato, cuando el pH está por encima del pKa de los ácidos borónicos, mientras que el equilibrio se desplaza hacia la formación de ácidos borónicos y dioles por debajo de este pKa[63].
Se puede acceder a la reversibilidad de los enlaces B-O en los ésteres borónicos y boroxinas a través de vías tanto disociativas como asociativas, lo que permite el ajuste fino de las propiedades del material.
Debido al rápido intercambio dinámico sin catalizador en condiciones ambientales y medios acuosos, esta reacción se ha utilizado en hidrogeles sensibles a estímulos con propiedades dinámicas.
Se necesitan nuevas estrategias para alcanzar el delicado equilibrio entre la capacidad de reprocesado y la resistencia a la fluencia.
- Ventajas: Los enlaces B-O reversibles han demostrado ser muy versátiles y prometedores como enlaces cruzados dinámicos para el diseño de polímeros auroreparantes y reprocesables.
- Desventajas: La rápida cinética de intercambio de enlaces dinámicos que permite la reprocesabilidad a temperatura ambiente conduce a materiales con baja resistencia al creep en condiciones moderadas. No aplicable a materiales estructurales.
3.8 - INTERCAMBIO DE DISULFUROS
El intercambio de disulfuro es una de las químicas de intercambio más estudiadas para el diseño de materiales dinámicos.
Las químicas basadas en azufre más comúnmente exploradas en este sentido son: (i) intercambio tiol/disulfuro, promovido por la presencia de tiolatos[64] , e (ii) intercambio de disulfuros [43].
Intercambio tiol/disulfuro
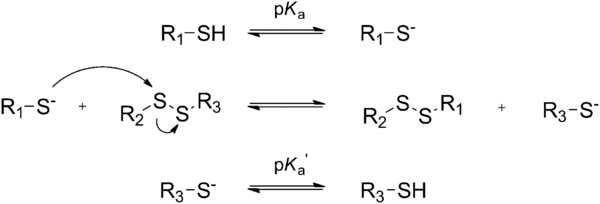
El intercambio tiol/disulfuro es una de las químicas reversibles más populares.
El mecanismo de intercambio tiol-disulfuro implica el desplazamiento nucleofílico de un anión tiolato del disulfuro, mediante el ataque de otro anión tiolato[65–68].
La reacción requiere un tiol desprotonado, la reacción puede controlarse catalíticamente elevando el pH por encima de las condiciones neutras, normalmente utilizando acelerantes de base amina. Esta química se ha empleado en polímeros para muchas aplicaciones diferentes[65–68].
- Ventajas: Química bien conocida. Escalable y aplicable en gran cantidad de polímeros.
- Desventajas: La fácil oxidación en aire de tiolatos en medio neutro y básico hace que disminuya el mecanismo de los materiales.
INTERCAMBIO DE DISULFUROS
El intercambio de disulfuros es una de las químicas más empleadas para síntesis de vitrimeros. Según la bibliografía, el intercambio de disulfuros se produce en presencia de catalizadores, a temperaturas moderadas o bajo radiación UV a temperatura ambiente. En las redes basadas en disulfuros, se han descrito procesos tanto disociativos como asociativos[69].
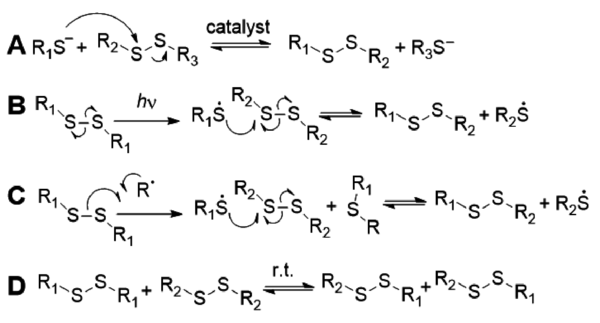
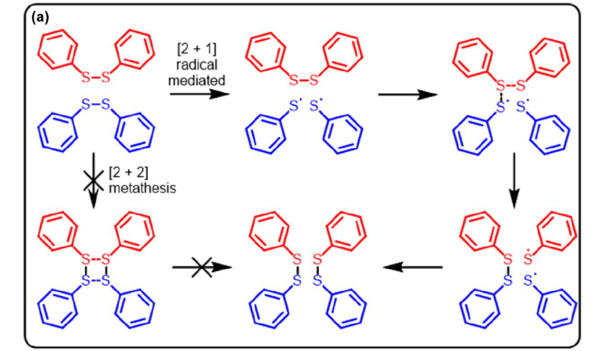
El mecanismo de intercambio de disulfuro puede ocurrir por vía aniónica o radicalaria. En la vía aniónica, el ataque del anión tiolato al enlace disulfuro forma un nuevo enlace disulfuro y aniones tiolato a través de la escisión heterolítica del enlace S-S, donde el anión tiolato se genera en condiciones básicas o por adición de catalizadores (A)[70,71] . La vía radicalaria incluye la escisión homolítica del enlace S-S y la transferencia del radical y la reacción cruzada en respuesta a la luz (B)[72] o mediante la adición de un iniciador radical (C)[73]. La metátesis de disulfuro aromático en se ha estudiado ampliamente y se ha demostrado que funciona también a temperatura ambiente (D)[34,35,74–76].
Los disulfuros aromáticos han demostrado gran dinamismo y son uno de los enlaces más empleados para la obtención de vitrímeros. Se ha demostrado por varios grupos que el intercambio de disulfuros aromáticos ocurre por vía radicalaria y no por metátesis. Las moléculas de disulfuro aromático, que pueden incorporarse fácilmente a los sistemas poliméricos. Los disulfuros aromáticos se empleado con éxito por CIDETEC y otros para la preparación de nuevos sistemas poliméricos dinámicos, como elastómeros de poli(urea-uretano) sin catalizador[44], autorreparables y procesables térmicamente, o composites epoxi reprocesables, reparables y reciclable[34,35,77–79].
A día de hoy, los disulfuros aromáticos son los enlaces dinámicos más prometedores para obtener materiales vitriméricos comerciales de alto rendimiento
- Ventajas: Fácil industrialización. Se puede obtener un control preciso de la cinética de intercambio. Tiempos de relajación bajos a altas temperaturas. Posibilidad de obtener vitrimeros con un amplio rango de Tgs (-40 °C – 190 °C). Alta resistencia a disolventes siendo fácilmente soluble en agentes químicos específicos. Fácil reprocesado y reparación.
- Desventajas: Estabilidad térmica hasta 210 °C.
La fácil disponibilidad del disulfuro de 4-aminofenilo (4-AFD) convierte a los vitrímeros epoxídicos que contienen disulfuro aromático en uno de los materiales más versátiles y en los principales candidatos para su implantación en aplicaciones industriales. Ofrecen muchas ventajas en comparación con otros vitrímeros existentes: escalabilidad, simplicidad, fácil procesamiento y excelentes propiedades mecánicas, y su uso en aplicaciones industriales es sencillo.
4 - PRODUCTOS COMERCIALES
Actualmente se conocen dos familias de resinas vitriméricas disponibles en el mercado. Mallinda (EE.UU.) comercializa la familia de vitrímeros VITRIMAXTM. Estos vitrimeros se basan en una resina termoestable de poliimina que se puede formular a partir de una combinación de reticulantes de diamina, dialdehído y triamina mediante la condensación de imina en ausencia de cualquier catalizador. Esta familia de resinas permite la soldadura covalente, el moldeo, el remoldeo y el reciclado, y actualmente se comercializan dos resinas, con valores de Tg de 100°C y 130ºC respectivamente[80]. ATSP Innovations (EEUU) comercializa una familia de polímeros de alta temperatura y alto rendimiento denominados copoliésteres termoendurecibles aromáticos, bajo las marcas comerciales EsthermTM, Self-BondTM y NOWETM, diseñados para su uso en aplicaciones tribológicas, adhesivas, estructurales y electrónicas. Permiten su reciclado como los termoplásticos, así como la des-unión y re-unión adhesiva. Estos vitrímeros están basados en reacciones de transesterificación y son estables hasta al menos 350 ℃[81].
Además, existe otras familias de resinas disponibles comercialmente que no están clasificadas como vitrímeros sino que se basan en diversas químicas dinámicas. Aditya Birla Chemicals (India), comercializa la tecnología Recyclamine, originalmente perteneciente a Connora Technologies, que es una familia de agentes de curado basados en aminas que contienen puntos de escisión diseñados de forma específica, los cuales, bajo condiciones predeterminadas convierten las resinas epoxi termoestables con las que se combina en termoplásticos. Ello permite sumergir el composite en un solvente de bajo pH a temperatura elevada, convirtiendo la resina en un epoxi termoplástico mientras se libera el tejido, de manera que tanto la resina como la fibra pueden reutilizarse[82]. Sus valores típicos de Tg oscilan entre 90°C y 130°C. Actualmente ofrecen dos categorías de productos basados en la tecnología Recyclamine: la serie Briozen Recyclable (sistemas formulados con epoxi basados en la tecnología Recyclamine) y los bloques de construcción Recyclamine. Swancor (Taiwán) comercializa dos nuevos productos, EzCiclo y CleaVER. Concretamente EzCiclo es una resina epoxi que puede ser reciclada mediante solvólisis con el solvente CleaVER, de manera que se pueden separar los tejidos de la resina, que se recupera en forma de oligómeros[83].
Finalmente, cabe mencionar varias familias de termoplásticos en el mercado basados en enfoques de desreticulación inversa que son termoformables, soldables y reciclables. Arkema (Francia), comercializa la resina Elium, un termoplástico de metacrilato de metilo (MMA) que, como una resina termoestable, exhibe altas propiedades mecánicas. Los composites fabricados con resina Elium se pueden reciclar después del final de su vida útil de dos maneras diferentes. La primera implica triturar y hacer un compounding de fibra corta y la segunda se basa en un proceso de termólisis que permite la recuperación de fibras y monómeros mediante despolimerización. La temperatura máxima continua en servicio de estas resinas es de 85°C[84]. Cecence (Reino Unido) comercializa una familia de productos bajo la marca K_Series: K_Chip, K_Plate y K_Rod, todos ellos basados en enfoques de descruzamiento inverso, con una temperatura máxima de uso continuo de 100°C[85]. SustFibre (España), spin-off creada por el CSIC, comercializa la resina acrílica Akelite, con buenas propiedades mecánicas y la capacidad de ser termoconformada y soldada tras su curado. Además, la fibra puede recuperarse mediante inmersión del composite en acetona[86].
La siguiente tabla resume las principales características de los productos comerciales mencionados:
| Producto | Química | Funcionalidades que ofrecen | Límite térmico |
| VITRIMAXTM (Mallinda) | Vitrimero (poliimida termoestable con una combinación de endurecedores de diamina, dialdehído y triamine, basado en reacciones de intercambio imina-amina) | Soldadura, moldeo y reciclado mediante disolución | Tg=130ºC |
| EsthermTM, Self-BondTM y NOWETM
(ATSP) |
Vitrimero (copoliésteres termoendurecibles aromáticos, basado en reacciones de transesterificación) | Reciclado similar a termoplásticos, uniones/des-uniones/re-uniones adhesivas | T uso=350ºC |
| Recyclamine (Aditya Birla) | Química dinámica (endurecedor de éter de poliamina escisible para epoxi termoestable) | Reciclado mediante disolución | Tg=110ºC |
| EzCiclo
(Swancor) |
Química dinámica | Reciclado mediante disolución con CleaVER | Desconocido |
| Elium
(Arkema) |
Termoplástico (Metacrilato de metilo MMA que polimeriza con peróxidos) | Soldadura, moldeo y reciclado mediante disolución o compounding | T uso= 85ºC |
| K-series (Cecence) | Termoplástico (epoxi polimerizable in situ) | Moldeo y reciclado basado en re-moldeo. | T uso= 100ºC |
| Akelite (SustFibre) | Termoplástico (resina acrílica reactiva que polimeriza con peróxido de benzoílo) | Soldadura, termoconformado y reciclado mediante disolución en acetona | Desconocido |
5 - BIBLIOGRAFÍA
[1] Andrady, A.L.; Neal, M.A. Applications and Societal Benefits of Plastics. Philosophical Transactions of the Royal Society B: Biological Sciences 2009, 364, 1977–1984, doi:10.1098/rstb.2008.0304.
[2] Cantor, K.M.; Watts, P. 12 - Plastics Processing. In Applied Plastics Engineering Handbook; Kutz, M., Ed.; William Andrew Publishing: Oxford, 2011; pp. 195–203 ISBN 978-1-4377-3514-7.
[3] Vidil, T.; Tournilhac, F.; Musso, S.; Robisson, A.; Leibler, L. Control of Reactions and Network Structures of Epoxy Thermosets. Prog Polym Sci 2016, 62, 126–179, [doi:https://doi.org/10.1016/j.progpolymsci.2016.06.003. doi:https://doi.org/10.1016/j.progpolymsci.2016.06.003.]
[4] Helms, B.A.; Russell, T.P. Reaction: Polymer Chemistries Enabling Cradle-to-Cradle Life Cycles for Plastics. Chem 2016, 1, 816–818.
[5] Hopewell, J.; Dvorak, R.; Kosior, E. Plastics Recycling: Challenges and Opportunities. Philosophical Transactions of the Royal Society B: Biological Sciences 2009, 364, 2115–2126.
[6] Post, W.; Susa, A.; Blaauw, R.; Molenveld, K.; Knoop, R.J.I. A Review on the Potential and Limitations of Recyclable Thermosets for Structural Applications. Polymer Reviews 2020, 60, 359–388, doi:10.1080/15583724.2019.1673406.
[7] Bin Rusayyis, M.; Torkelson, J.M. Recyclable Polymethacrylate Networks Containing Dynamic Dialkylamino Disulfide Linkages and Exhibiting Full Property Recovery. Macromolecules 2020, 53, 8367–8373, doi:10.1021/acs.macromol.0c01539.
[8] Majumdar, S.; Zhang, H.; Soleimani, M.; van Benthem, R.A.T.M.; Heuts, J.P.A.; Sijbesma, R.P. Phosphate Triester Dynamic Covalent Networks. ACS Macro Lett 2020, 9, 1753–1758, doi:10.1021/acsmacrolett.0c00636.
[9] Kloxin, C.J.; Bowman, C.N. Covalent Adaptable Networks: Smart, Reconfigurable and Responsive Network Systems. Chem Soc Rev 2013, 42, 7161–7173, doi:10.1039/C3CS60046G.
[10] Bowman, C.; Du Prez, F.; Kalow, J. Introduction to Chemistry for Covalent Adaptable Networks. Polym Chem 2020, 11, 5295–5296, doi:10.1039/D0PY90102D.
[11] Kloxin, C.J.; Scott, T.F.; Adzima, B.J.; Bowman, C.N. Covalent Adaptable Networks (CANs): A Unique Paradigm in Cross-Linked Polymers. Macromolecules 2010, 43, 2643–2653, doi:10.1021/ma902596s.
[12] Alabiso, W.; Schlögl, S. The Impact of Vitrimers on the Industry of the Future: Chemistry, Properties and Sustainable Forward-Looking Applications. Polymers (Basel) 2020, 12, doi:10.3390/polym12081660.
[13] Van Zee, N.J.; Nicolaÿ, R. Vitrimers: Permanently Crosslinked Polymers with Dynamic Network Topology. Prog Polym Sci 2020, 104, 101233, [doi:https://doi.org/10.1016/j.progpolymsci.2020.101233. doi:https://doi.org/10.1016/j.progpolymsci.2020.101233.]
[14] Chakma, P.; Konkolewicz, D. Dynamic Covalent Bonds in Polymeric Materials. Angewandte Chemie International Edition 2019, 58, 9682–9695, [doi:https://doi.org/10.1002/anie.201813525. doi:https://doi.org/10.1002/anie.201813525.]
[15] Scheutz, G.M.; Lessard, J.J.; Sims, M.B.; Sumerlin, B.S. Adaptable Crosslinks in Polymeric Materials: Resolving the Intersection of Thermoplastics and Thermosets. J Am Chem Soc 2019, 141, 16181–16196, doi:10.1021/jacs.9b07922.
[16] Podgórski, M.; Fairbanks, B.D.; Kirkpatrick, B.E.; McBride, M.; Martinez, A.; Dobson, A.; Bongiardina, N.J.; Bowman, C.N. Toward Stimuli-Responsive Dynamic Thermosets through Continuous Development and Improvements in Covalent Adaptable Networks (CANs). Advanced Materials 2020, 32, 1906876, [doi:https://doi.org/10.1002/adma.201906876. doi:https://doi.org/10.1002/adma.201906876.]
[17] Porath, L.E.; Evans, C.M. Importance of Broad Temperature Windows and Multiple Rheological Approaches for Probing Viscoelasticity and Entropic Elasticity in Vitrimers. Macromolecules 2021, 54, 4782–4791, doi:10.1021/acs.macromol.0c02800.
[18] Lessard, J.J.; Scheutz, G.M.; Sung, S.H.; Lantz, K.A.; Epps, T.H.I.I.I.; Sumerlin, B.S. Block Copolymer Vitrimers. J Am Chem Soc 2020, 142, 283–289, doi:10.1021/jacs.9b10360.
[19] Ling, F.; Liu, Z.; Chen, M.; Wang, H.; Zhu, Y.; Ma, C.; Wu, J.; Huang, G. Compatibility Driven Self-Strengthening during the Radical-Responsive Remolding Process of Poly-Isoprene Vitrimers. J Mater Chem A Mater 2019, 7, 25324–25332, doi:10.1039/C9TA09292G.
[20] Li, L.; Chen, X.; Jin, K.; Rusayyis, M. Bin; Torkelson, J.M. Arresting Elevated-Temperature Creep and Achieving Full Cross-Link Density Recovery in Reprocessable Polymer Networks and Network Composites via Nitroxide-Mediated Dynamic Chemistry. Macromolecules 2021, 54, 1452–1464, doi:10.1021/acs.macromol.0c01691.
[21] Meng, F.; Saed, M.O.; Terentjev, E.M. Elasticity and Relaxation in Full and Partial Vitrimer Networks. Macromolecules 2019, 52, 7423–7429, doi:10.1021/acs.macromol.9b01123.
[22] Porath, L.E.; Evans, C.M. Importance of Broad Temperature Windows and Multiple Rheological Approaches for Probing Viscoelasticity and Entropic Elasticity in Vitrimers. Macromolecules 2021, 54, 4782–4791, doi:10.1021/acs.macromol.0c02800.
[23] Jourdain, A.; Asbai, R.; Anaya, O.; Chehimi, M.M.; Drockenmuller, E.; Montarnal, D. Rheological Properties of Covalent Adaptable Networks with 1,2,3-Triazolium Cross-Links: The Missing Link between Vitrimers and Dissociative Networks. Macromolecules 2020, 53, 1884–1900, doi:10.1021/acs.macromol.9b02204.
[24] Fortman, D.J.; Brutman, J.P.; Cramer, C.J.; Hillmyer, M.A.; Dichtel, W.R. Mechanically Activated, Catalyst-Free Polyhydroxyurethane Vitrimers. J Am Chem Soc 2015, 137, 14019–14022, doi:10.1021/jacs.5b08084.
[25] Brutman, J.P.; Fortman, D.J.; De Hoe, G.X.; Dichtel, W.R.; Hillmyer, M.A. Mechanistic Study of Stress Relaxation in Urethane-Containing Polymer Networks. J Phys Chem B 2019, 123, 1432–1441, doi:10.1021/acs.jpcb.8b11489.
[26] Elling, B.R.; Dichtel, W.R. Reprocessable Cross-Linked Polymer Networks: Are Associative Exchange Mechanisms Desirable? ACS Cent Sci 2020, 6, 1488–1496, doi:10.1021/acscentsci.0c00567.
[27] Guerre, M.; Taplan, C.; Winne, J.M.; Du Prez, F.E. Vitrimers: Directing Chemical Reactivity to Control Material Properties. Chem. Sci. 2020, 11, 4855–4870, doi:10.1039/D0SC01069C.
[28] Obadia, M.M.; Jourdain, A.; Cassagnau, P.; Montarnal, D.; Drockenmuller, E. Tuning the Viscosity Profile of Ionic Vitrimers Incorporating 1,2,3-Triazolium Cross-Links. Adv Funct Mater 2017, 27, 1703258, [doi:https://doi.org/10.1002/adfm.201703258. doi:https://doi.org/10.1002/adfm.201703258.]
[29] Yang, Y.; Terentjev, E.M.; Wei, Y.; Ji, Y. Solvent-Assisted Programming of Flat Polymer Sheets into Reconfigurable and Self-Healing 3D Structures. Nat Commun 2018, 9, 1906, doi:10.1038/s41467-018-04257-x.
[30] Van Lijsebetten, F.; Holloway, J.O.; Winne, J.M.; Du Prez, F.E. Internal Catalysis for Dynamic Covalent Chemistry Applications and Polymer Science. Chem Soc Rev 2020, 49, 8425–8438, doi:10.1039/D0CS00452A.
[31] Cuminet, F.; Caillol, S.; Dantras, É.; Leclerc, É.; Ladmiral, V. Neighboring Group Participation and Internal Catalysis Effects on Exchangeable Covalent Bonds: Application to the Thriving Field of Vitrimer Chemistry. Macromolecules 2021, 54, 3927–3961, doi:10.1021/acs.macromol.0c02706.
[32] Zhang, H.; Majumdar, S.; van Benthem, R.A.T.M.; Sijbesma, R.P.; Heuts, J.P.A. Intramolecularly Catalyzed Dynamic Polyester Networks Using Neighboring Carboxylic and Sulfonic Acid Groups. ACS Macro Lett 2020, 9, 272–277, doi:10.1021/acsmacrolett.9b01023.
[33] Delahaye, M.; Tanini, F.; Holloway, J.O.; Winne, J.M.; Du Prez, F.E. Double Neighbouring Group Participation for Ultrafast Exchange in Phthalate Monoester Networks. Polym Chem 2020, 11, 5207–5215, doi:10.1039/D0PY00681E.
[34] Ruiz de Luzuriaga, A.; Martin, R.; Markaide, N.; Rekondo, A.; Cabanero, G.; Rodriguez, J.; Odriozola, I. Epoxy Resin with Exchangeable Disulfide Crosslinks to Obtain Reprocessable, Repairable and Recyclable Fiber-Reinforced Thermoset Composites. Mater Horiz 2016, 3, 241–247, doi:10.1039/c6mh00029k.
[35] Ruiz de Luzuriaga, A.; Martin, R.; Markaide, N.; Rekondo, A.; Cabanero, G.; Rodriguez, J.; Odriozola, I. Correction: Epoxy Resin with Exchangeable Disulfide Crosslinks to Obtain Reprocessable, Repairable and Recyclable Fiber-Reinforced Thermoset Composites. Mater Horiz 2020, 7, 2460–2461, doi:10.1039/d0mh90047h.
[36] Rowan, S.J.; Cantrill, S.J.; Cousins, G.R.L.; Sanders, J.K.M.; Stoddart, J.F. Dynamic Covalent Chemistry. Angewandte Chemie International Edition 2002, 41, 898–952, doi:10.1002/1521-3773(20020315)41:6<898::AID-ANIE898>3.0.CO;2-E.
[37] Wojtecki, R.J.; Meador, M.A.; Rowan, S.J. Using the Dynamic Bond to Access Macroscopically Responsive Structurally Dynamic Polymers. Nat Mater 2011, 10, 14–27, doi:10.1038/nmat2891.
[38] Roy, N.; Bruchmann, B.; Lehn, J.-M. DYNAMERS: Dynamic Polymers as Self-Healing Materials. Chem Soc Rev 2015, 44, 3786–3807, doi:10.1039/C5CS00194C.
[39] Maeda, T.; Otsuka, H.; Takahara, A. Dynamic Covalent Polymers: Reorganizable Polymers with Dynamic Covalent Bonds. Prog Polym Sci 2009, 34, 581–604, doi:10.1016/j.progpolymsci.2009.03.001.
[40] Chen, X.; Dam, M.A.; Ono, K.; Mal, A.; Shen, H.; Nutt, S.R.; Sheran, K.; Wudl, F. A Thermally Re-Mendable Cross-Linked Polymeric Material. Science (1979) 2002, 295, 1698–1702, doi:10.1126/science.1065879.
[41] Denissen, W.; Rivero, G.; Nicolaÿ, R.; Leibler, L.; Winne, J.M.; Du Prez, F.E. Vinylogous Urethane Vitrimers. Adv Funct Mater 2015, 25, 2451–2457, doi:10.1002/adfm.201404553.
[42] Bowman, C.N.; Kloxin, C.J. Covalent Adaptable Networks: Reversible Bond Structures Incorporated in Polymer Networks. Angewandte Chemie International Edition 2012, 51, 4272–4274, doi:10.1002/anie.201200708.
[43] Azcune, I.; Odriozola, I. Aromatic Disulfide Crosslinks in Polymer Systems: Self-Healing, Reprocessability, Recyclability and More. Eur Polym J 2016, 84, 147–160, doi:10.1016/j.eurpolymj.2016.09.023.
[44] Erice, A.; Ruiz de Luzuriaga, A.; Matxain, J.M.; Ruipérez, F.; Asua, J.M.; Grande, H.-J.; Rekondo, A. Reprocessable and Recyclable Crosslinked Poly(Urea-Urethane)s Based on Dynamic Amine/Urea Exchange. Polymer (Guildf) 2018, 145, 127–136, doi:10.1016/j.polymer.2018.04.076.
[45] Winne, J.M.; Leibler, L.; Du Prez, F.E. Dynamic Covalent Chemistry in Polymer Networks: A Mechanistic Perspective. Polym Chem 2019, 10, 6091–6108, doi:10.1039/C9PY01260E.
[46] Montarnal, D.; Capelot, M.; Tournilhac, F.; Leibler, L. Silica-Like Malleable Materials from Permanent Organic Networks. Science (1979) 2011, 334, 965–968, doi:10.1126/science.1212648.
[47] Denissen, W.; Winne, J.M.; Du Prez, F.E. Vitrimers: Permanent Organic Networks with Glass-like Fluidity. Chem Sci 2016, 7, 30–38, doi:10.1039/C5SC02223A.
[48] Krishnakumar, B.; Sanka, R.V.S.P.; Binder, W.H.; Parthasarthy, V.; Rana, S.; Karak, N. Vitrimers: Associative Dynamic Covalent Adaptive Networks in Thermoset Polymers. Chemical Engineering Journal 2020, 385, 123820, [doi:https://doi.org/10.1016/j.cej.2019.123820. doi:https://doi.org/10.1016/j.cej.2019.123820.]
[49] Self, J.L.; Dolinski, N.D.; Zayas, M.S.; Read de Alaniz, J.; Bates, C.M. Brønsted-Acid-Catalyzed Exchange in Polyester Dynamic Covalent Networks. ACS Macro Lett 2018, 7, 817–821, doi:10.1021/acsmacrolett.8b00370.
[50] Otera, Junzo. Transesterification. Chem Rev 1993, 93, 1449–1470, doi:10.1021/cr00020a004.
[51] Yu, K.; Taynton, P.; Zhang, W.; Dunn, M.L.; Qi, H.J. Reprocessing and Recycling of Thermosetting Polymers Based on Bond Exchange Reactions. RSC Adv. 2014, 4, 10108–10117, doi:10.1039/C3RA47438K.
[52] Obadia, M.M.; Mudraboyina, B.P.; Serghei, A.; Montarnal, D.; Drockenmuller, E. Reprocessing and Recycling of Highly Cross-Linked Ion-Conducting Networks through Transalkylation Exchanges of C–N Bonds. J Am Chem Soc 2015, 137, 6078–6083, doi:10.1021/jacs.5b02653.
[53] Kantor, S.W.; Grubb, W.T.; Osthoff, R.C. The Mechanism of the Acid- and Base-Catalyzed Equilibration of Siloxanes. J Am Chem Soc 1954, 76, 5190–5197, doi:10.1021/ja01649a076.
[54] Osthoff, R.C.; Bueche, A.M.; Grubb, W.T. Chemical Stress-Relaxation of Polydimethylsiloxane Elastomers 1. J Am Chem Soc 1954, 76, 4659–4663, doi:10.1021/ja01647a052.
[55] Gilbert, A.R.; Kantor, S.W. Transient Catalysts for the Polymerization of Organosiloxanes. Journal of Polymer Science 1959, 40, 35–58, doi:10.1002/pol.1959.1204013603.
[56] Schmolke, W.; Perner, N.; Seiffert, S. Dynamically Cross-Linked Polydimethylsiloxane Networks with Ambient-Temperature Self-Healing. Macromolecules 2015, 48, 8781–8788, doi:10.1021/acs.macromol.5b01666.
[57] Wu, X.; Yang, X.; Yu, R.; Zhao, X.-J.; Zhang, Y.; Huang, W. A Facile Access to Stiff Epoxy Vitrimers with Excellent Mechanical Properties via Siloxane Equilibration. J Mater Chem A Mater 2018, 6, 10184–10188, doi:10.1039/C8TA02102C.
[58] Li, X.; Yu, R.; Zhao, T.; Zhang, Y.; Yang, X.; Zhao, X.; Huang, W. A Self-Healing Polysiloxane Elastomer Based on Siloxane Equilibration Synthesized through Amino-Ene Michael Addition Reaction. Eur Polym J 2018, 108, 399–405, doi:10.1016/j.eurpolymj.2018.09.021.
[59] Nishimura, Y.; Chung, J.; Muradyan, H.; Guan, Z. Silyl Ether as a Robust and Thermally Stable Dynamic Covalent Motif for Malleable Polymer Design. J Am Chem Soc 2017, 139, 14881–14884, doi:10.1021/jacs.7b08826.
[60] Scholl, M.; Ding, S.; Lee, C.W.; Grubbs, R.H. Synthesis and Activity of a New Generation of Ruthenium-Based Olefin Metathesis Catalysts Coordinated with 1,3-Dimesityl-4,5-Dihydroimidazol-2-Ylidene Ligands. Org Lett 1999, 1, 953–956, doi:10.1021/ol990909q.
[61] Lu, Y.-X.; Guan, Z. Olefin Metathesis for Effective Polymer Healing via Dynamic Exchange of Strong Carbon–Carbon Double Bonds. J Am Chem Soc 2012, 134, 14226–14231, doi:10.1021/ja306287s.
[62] Lu, Y.-X.; Tournilhac, F.; Leibler, L.; Guan, Z. Making Insoluble Polymer Networks Malleable via Olefin Metathesis. J Am Chem Soc 2012, 134, 8424–8427, doi:10.1021/ja303356z.
[63] Roy, D.; Cambre, J.N.; Sumerlin, B.S. Triply-Responsive Boronic Acid Block Copolymers: Solution Self-Assembly Induced by Changes in Temperature, PH, or Sugar Concentration. Chemical Communications 2009, 2106, doi:10.1039/b900374f.
[64] Fernandes, P.A.; Ramos, M.J. Theoretical Insights into the Mechanism for Thiol/Disulfide Exchange. Chemistry – A European Journal 2004, 10, 257–266, doi:10.1002/chem.200305343.
[65] Canadell, J.; Goossens, H.; Klumperman, B. Self-Healing Materials Based on Disulfide Links. Macromolecules 2011, 44, 2536–2541, doi:10.1021/ma2001492.
[66] An, S.Y.; Noh, S.M.; Nam, J.H.; Oh, J.K. Dual Sulfide–Disulfide Crosslinked Networks with Rapid and Room Temperature Self‐Healability. Macromol Rapid Commun 2015, 36, 1255–1260, doi:10.1002/marc.201500123.
[67] Pepels, M.; Filot, I.; Klumperman, B.; Goossens, H. Self-Healing Systems Based on Disulfide–Thiol Exchange Reactions. Polym Chem 2013, 4, 4955, doi:10.1039/c3py00087g.
[68] Gyarmati, B.; Némethy, Á.; Szilágyi, A. Reversible Disulphide Formation in Polymer Networks: A Versatile Functional Group from Synthesis to Applications. Eur Polym J 2013, 49, 1268–1286, doi:10.1016/j.eurpolymj.2013.03.001.
[69] Nevejans, S.; Ballard, N.; Miranda, J.I.; Reck, B.; Asua, J.M. The Underlying Mechanisms for Self-Healing of Poly(Disulfide)s. Physical Chemistry Chemical Physics 2016, 18, 27577–27583, doi:10.1039/C6CP04028D.
[70] Black, S.P.; Sanders, J.K.M.; Stefankiewicz, A.R. Disulfide Exchange: Exposing Supramolecular Reactivity through Dynamic Covalent Chemistry. Chem. Soc. Rev. 2014, 43, 1861–1872, doi:10.1039/C3CS60326A.
[71] García, F.; Smulders, M.M.J. Dynamic Covalent Polymers. J Polym Sci A Polym Chem 2016, 54, 3551–3577, doi:10.1002/pola.28260.
[72] Banchereau, E.; Lacombe, S.; Ollivier, J. Solution Reactivity of Thiyl Radicals with Molecular Oxygen: Unsensitized Photooxidation of Dimethyldisulfide. Tetrahedron Lett 1995, 36, 8197–8200, doi:10.1016/0040-4039(95)01698-H.
[73] Fairbanks, B.D.; Singh, S.P.; Bowman, C.N.; Anseth, K.S. Photodegradable, Photoadaptable Hydrogels via Radical-Mediated Disulfide Fragmentation Reaction. Macromolecules 2011, 44, 2444–2450, doi:10.1021/ma200202w.
[74] Ruiz de Luzuriaga, A.; Matxain, J.M.; Ruiperez, F.; Martin, R.; Asua, J.M.; Cabanero, G.; Odriozola, I. Transient Mechanochromism in Epoxy Vitrimer Composites Containing Aromatic Disulfide Crosslinks. Journal of Materials Chemistry C: Materials for Optical and Electronic Devices 2016, 4, 6220–6223, doi:10.1039/c6tc02383e.
[75] Ruiz de Luzuriaga, A.; Solera, G.; Azcarate-Ascasua, I.; Boucher, V.; Grande, H.-J.; Rekondo, A. Chemical Control of the Aromatic Disulfide Exchange Kinetics for Tailor-Made Epoxy Vitrimers. Polymer (Guildf) 2022, 239, 124457, doi:10.1016/j.polymer.2021.124457.
[76] Rekondo, A.; Martin, R.; Ruiz de Luzuriaga, A.; Cabañero, G.; Grande, H.J.; Odriozola, I. Catalyst-Free Room-Temperature Self-Healing Elastomers Based on Aromatic Disulfide Metathesis. Mater. Horiz. 2014, 1, 237–240, doi:10.1039/C3MH00061C.
[77] Ruiz de Luzuriaga, A.; Markaide, N.; Salaberria, A.M.; Azcune, I.; Rekondo, A.; Grande, H.J. Aero Grade Epoxy Vitrimer towards Commercialization. Polymers (Basel, Switzerland) 2022, 14, 3180, doi:10.3390/polym14153180.
[78] Kosarli, M.; Foteinidis, G.; Tsirka, K.; Markaide, N.; Ruiz de Luzuriaga, A.; Zapateria, D.C.; Weidmann, S.; Paipetis, A.S. 3R Composites: Knockdown Effect Assessment and Repair Efficiency via Mechanical and NDE Testing. Applied Sciences 2022, 12, 7269, doi:10.3390/app12147269.
[79] Builes Cardenas, C.; Gayraud, V.; Rodriguez, M.E.; Costa, J.; Salaberria, A.M.; Ruiz de Luzuriaga, A.; Markaide, N.; Dasan Keeryadath, P.; Calderon Zapateria, D. Study into the Mechanical Properties of a New Aeronautic-Grade Epoxy-Based Carbon-Fiber-Reinforced Vitrimer. Polymers (Basel, Switzerland) 2022, 14, 1223, doi:10.3390/polym14061223.
[80] Taynton, P.; Ni, H.; Zhu, C.; Yu, K.; Loob, S.; Jin, Y.; Qi, H.J.; Zhang, W. Repairable Woven Carbon Fiber Composites with Full Recyclability Enabled by Malleable Polyimine Networks. Advanced Materials 2016, 28, doi:10.1002/adma.201505245.
[81] Frich, D.; Goranov, K.; Schneggenburger, L.; Economy, J. Novel High-Temperature Aromatic Copolyester Thermosets: Synthesis, Characterization, and Physical Properties. Macromolecules 1996, 29, doi:10.1021/ma960862d.
[82] La Rosa, A.D.; Blanco, I.; Banatao, D.R.; Pastine, S.J.; Björklund, A.; Cicala, G. Innovative Chemical Process for Recycling Thermosets Cured with Recyclamines® by Converting Bio-Epoxy Composites in Reusable Thermoplastic-an LCA Study. Materials 2018, 11, doi:10.3390/ma11030353.
[84] Https://Www.Arkema.Com/Global/En/Products/Product-Finder/Product-Range/Incubator/Elium_resins/.
[85] Https://Cecence.Com/Products-Services/.
[86] Carnicero, R.; Cano, L.; Lopez-Manchado, M.A.; Verdejo, R. Manufacturing, Testing and Recycling of a Small Recyclable Wind Turbine Blade. In Proceedings of the Journal of Physics: Conference Series; 2022; Vol. 2265.
Document information
Published on 15/10/24
Submitted on 17/07/24
Licence: CC BY-NC-SA license
Share this document
claim authorship
Are you one of the authors of this document?