Leoncruz82 (talk | contribs) (Created page with "==Estimación Bayesiana del Número Reproductivo Básico en un Brote de Chikungunya en Acapulco, Guerrero== '''María Guadalupe Vázquez-Peña<sup>a</sup>, Cruz Vargas-De-Le...") |
Leoncruz82 (talk | contribs) m (Leoncruz82 moved page Draft Vargas-De-Leon 400593385 to Review 405728658381) |
(No difference)
| |
Revision as of 00:55, 10 September 2024
Estimación Bayesiana del Número Reproductivo Básico en un Brote de Chikungunya en Acapulco, Guerrero
María Guadalupe Vázquez-Peñaa, Cruz Vargas-De-LeónAutor de correspondencia: leoncruz82@yahoo.com.mxb,c, Rafael Martínez-Fonsecad, Jorge Velázquez-Castroe
Resumen
El chikungunya es una enfermedad viral transmitida por vectores, causada por los mosquitos Aedes aegypti y Aedes albopictus. No existe un tratamiento específico ni una vacuna disponible. En este trabajo, presentamos un modelo hospedero-vector que considera dos estructuras de edad: la edad cronológica y la edad de la infección asintomática. Este modelo considera la variabilidad en el período de recaídas y en la susceptibilidad al virus del chikungunya. A partir de este sistema de ecuaciones integrales y diferenciales, derivamos un caso particular en forma de ecuaciones diferenciales ordinarias (EDO) para ajustarlo a los datos de un brote ocurrido en 2015 en Acapulco, México. Utilizamos el enfoque Bayesiano junto con el método de Monte Carlo Hamiltoniano para estimar los parámetros del modelo en EDO y el número reproductivo básico (). Estimamos que el es 2.61, con un intervalo de credibilidad del 95% de (1.66, 3.80), lo cual es consistente con otros informes en la literatura.
Palabras clave: Chikungunya; Modelo hospedero-vector; Brote epidémico; Estimación Bayesiana; Número reproductivo básico.
2 Introducción
La fiebre chikungunya es una enfermedad viral transmitida a los humanos por mosquitos del género Aedes [1]. El virus, que da nombre a la enfermedad, se describió en humanos por primera vez en 1952 en Tanzania, África, donde entre el 60% y el 80% de la población presentó síntomas de artralgia, fiebre y erupciones cutáneas. Muchas personas, tras el periodo agudo de la enfermedad, continuaron experimentando dolores articulares durante meses [2].
Entre 1960 y 1990, hubo brotes de fiebre chikungunya en varios países africanos, como República Democrática del Congo, Uganda, Angola, Sudáfrica y Nigeria [3]. En América, el primer caso se reportó en Saint Martin en 2013, y para diciembre de 2014, la enfermedad se había extendido a 17 países sudamericanos. Actualmente, se ha identificado en 45 países en el Caribe, América del Norte, América del Sur y América Central [3].
En México, el primer caso importado de fiebre chikungunya se presentó en mayo de 2014 [4]. A finales de ese año, se reportaron 155 casos en los estados de Chiapas, Guerrero, Oaxaca, Sonora y Sinaloa. Para la semana 40 epidemiológica, en 2015 se habían contabilizado 8,668 casos confirmados, siendo Guerrero el estado con la mayor cantidad de infectados, con el 18.38% [5]. Al final de ese año, se confirmaron un total de 12,588 casos de chikungunya [6].
Cuando una persona es picada por un mosquito infectado, los síntomas suelen comenzar entre 3 y 7 días después del período de incubación. Los síntomas incluyen dolor intenso en las articulaciones, fiebre superior a 39°C, dolor muscular y, ocasionalmente, náuseas, vómitos y erupciones cutáneas. El dolor articular puede ser tan intenso que resulta debilitante o incapacitante [2]. Tras una semana, la mayoría de los pacientes experimenta una notable mejora: la fiebre, el cansancio y la artralgia disminuyen significativamente en 1 o 2 semanas, aunque frecuentemente se produce una recaída [7]. Actualmente, no existe un tratamiento específico para la infección por chikungunya; el manejo se limita a aliviar los síntomas con medicación analgésica y antiinflamatoria [2].
Se ha reportado el fenómeno de recaída en las infecciones por chikungunya [8,9,10]. La recaída se define como la reaparición de artralgia debido a la persistencia del virus en las células del tejido musculoesquelético después de un período sin síntomas de al menos una semana [8] o después de un mes [10]. En un estudio de cohortes realizado en Francia, basado en datos de un sistema de vigilancia de laboratorio, se confirmó la infección inicial mediante una prueba de anticuerpos o PCR (reacción en cadena de la polimerasa). En este estudio, se reportaron recaídas de artralgia en el 72% de los pacientes; el número promedio de recaídas fue de 4 y el tiempo promedio entre dos recaídas fue de 8 semanas [8]. Por otro lado, un estudio transversal realizado en Acapulco, Guerrero, en diciembre de 2015, encontró que el 66% de la población (3,531 de 5,870 personas) se autoreportó de haber estado infectada; el 31.1% de los que sufrieron de chikungunya (1,098 de 3,531 personas) reportaron al menos una recaída al menos un mes después de recuperarse de la enfermedad. De estos, el 13% reportó exactamente una recaída, el 12% reportó dos recaídas, el 4% reportó tres recaídas y solo el 2% reportó más de cuatro recaídas [10].
La edad como factor de riesgo es común en las enfermedades infecciosas transmitidas por vectores. En el caso del chikungunya, un estudio de seropositividad reportó la frecuencia de positivos al virus en los siguientes grupos etarios: 33% en el grupo de 0 a 19 años, 62% en el de 20 a 39 años, 67.4% en el de 40 a 49 años, 75% en el de 50 a 59 años, 59% en el de 60 a 69 años, 25% en el de 70 a 79 años, y 33% en el de 80 años y más [11], lo que muestra una variabilidad en la susceptibilidad al virus.
La variabilidad en el período de recaídas y en la susceptibilidad al virus del chikungunya motivó a Vázquez-Peña, Vargas-De-León y Velázquez-Castro [12] a desarrollar un modelo hospedero-vector que considera tanto la edad cronológica como la edad de la infección asintomática. Este modelo se presentará en la Sección 2.
A partir de este modelo hospedero-vector con dos estructuras de edad, obtendremos un modelo en ecuaciones diferenciales ordinarias para el virus del chikungunya, tal como fue propuesto por Vázquez-Peña et al. [13], el cual se discutirá en la Sección 3.
En este trabajo, se propone estimar los parámetros y el número reproductivo básico utilizando un enfoque Bayesiano con los datos del brote de chikungunya en Acapulco, Guerrero [10]. Para ello, emplearemos el modelo hospedero-vector presentado en la Sección 3. La metodología del enfoque Bayesiano se describirá en la Sección 4, mientras que la estimación Bayesiana de los parámetros y del número reproductivo básico se presentará en la Sección 5. Finalmente, en la Sección 6, se realizarán algunos comentarios finales.
3 Modelo hospedero-vector con dos estructura de edades
Denotamos por y el número total de hospederos y vectores, respectivamente. Las poblaciones de hospederos y vectores se dividen en clases disjuntas según su estado epidemiológico. Para los hospederos, consideramos cuatro grupos: susceptibles, infectados, asintomáticos y recuperados. En contraste, los vectores se dividen únicamente en susceptibles e infectados.
La edad cronológica se denota por , de manera que representa la cantidad de hospederos susceptibles con edad cronológica en el tiempo . Entonces, el total de hospederos susceptibles está dado por . Suponemos que la probabilidad de transmisión del vector al hospedero depende de la edad del hospedero, lo cual se denota por .
La tasa de transmisión del vector infectado al hospedero susceptible está definida por , donde es el promedio de picaduras por unidad de tiempo, y es el número de picaduras que recibe el hospedero. Al mismo tiempo, la clase de hospederos susceptibles disminuye debido a la muerte natural a una tasa y a alguna estrategia de prevención, como la vacunación, enfocada únicamente a ciertos grupos de edad, la cual será modelada por el parámetro . Por lo tanto, definimos .
Bajo estas hipótesis, se formula la primera ecuación del modelo
|
|
Suponemos que todos los individuos nacen susceptibles a una tasa , de manera que obtenemos la condición de frontera
|
|
Una vez que un hospedero se ha infectado, permanece en dicha clase hasta que los síntomas desaparecen a una tasa o por muerte por causas naturales a una tasa . Consideramos que una fracción no se recuperará y pasará a la fase asintomática durante un tiempo , que representa la edad de la infección asintomática. La clase de hospederos asintomáticos se representa por , donde es el total de hospederos asintomáticos. Además, la tasa en que los síntomas de la enfermedad vuelven a manifestarse depende de la edad de la infección asintomática; por ende, los hospederos asintomáticos retornan a la clase de hospederos infectados en un tiempo . Con esto, se propone la segunda ecuación del modelo.
|
|
La clase de hospederos asintomáticos se reduce cuando los síntomas vuelven a manifestarse o por muerte por causas naturales, lo que da lugar a la siguiente ecuación del modelo:
|
|
Los hospederos infectados entran en la clase asintomática a una tasa , comenzando el conteo de la edad de la infección asintomática, lo que se traduce en la condición de frontera
|
|
Los hospederos infectados se recuperan de manera permanente a una tasa y permanecen en esa clase hasta la muerte por causas naturales a una tasa , lo que se representa en la cuarta ecuación diferencial del modelo
|
|
En cuanto a los vectores, suponemos que nacen y mueren a la misma tasa . Un vector nace susceptible y se infecta al picar a una persona con el virus, ya sea un hospedador infectado o un hospedador asintomático. De manera análoga al caso de los hospedadores, la tasa de transmisión depende de la probabilidad de que el contacto entre un hospedador infectado y un vector susceptible sea efectivo. Esta probabilidad se modela con el producto de la probabilidad de transmisión del virus y la cantidad promedio de picaduras por unidad de tiempo . Adicionalmente, se introduce el parámetro para tener en cuenta que la probabilidad de transmisión de un hospedero infectado a un vector es mayor que la tasa de transmisión de un hospedero asintomático a un vector. Por lo tanto, se considera que . Bajo estas suposiciones, obtenemos la quinta ecuación del modelo:
|
|
Después de que el vector se infecta a través del medio ya descrito, permanece en esa clase hasta morir, lo que se modela en la última ecuación del modelo:
|
|
Por lo que se obtiene el siguiente sistema integrodiferencial recientemente propuesto por Vázquez-Peña, Vargas-De-León y Velázquez-Castro para el virus de chikungunya [12]
|
|
(1) |
Si consideramos que el tamaño de la población de vectores se mantiene constante en el tiempo, , y observamos que la variable no esta acoplada en las demás ecuaciones, el modelo se reduce a
|
|
(2) |
Las condiciones iniciales están dadas por
|
|
Donde y representan la distribución inicial de los huéspedes susceptibles y de los hospederos asintomáticos con edad cronológica y edad de infección asintomática, respectivamente. e son el número inicial de hospederos y de vectores infectados, respectivamente.
3.1 Propiedades del sistema
El número reproductivo básico para el modelo (2) fue obtenido en [12]
|
|
(3) |
donde está dada por
|
|
(4) |
y por
|
|
(5) |
El punto de equilibrio libre de la enfermedad del sistema integro-diferencial (2) se obtiene al considerar , e iguales a cero simultáneamente, lo que resulta en , donde
|
|
(6) |
En [12], se utiliza una estrategia geométrica para demostrar la existencia del punto de equilibrio endémico cuando .
Las propiedades de las soluciones a tiempos largos se resumen en el siguiente teorema:
Teorema 1: (Ver [12]) i) Si , el punto de equilibrio libre de la enfermedad del sistema integro-diferencial (2) es global asintóticamente estable. ii) Si , existe un único punto de equilibrio endémico del sistema (2) y es global asintóticamente estable.
La primera parte del Teorema 1 se demostró utilizando el segundo método de Lyapunov. Se construyó el siguiente funcional de Lyapunov , que es una combinación de una funcional tipo Volterra y funcionales lineales
|
|
donde es la siguiente función auxiliar:
|
|
(7) |
para todo .
La segunda parte del Teorema 1 se demostró usando una funcional de Lyapunov , que es una combinación de funcionales tipo Volterra , definida por
|
|
donde es la siguiente función auxiliar:
|
|
para todo .
La estrategia de construcción de funcionales de Lyapunov tipo Volterra ha sido ampliamente utilizada en epidemiología matemática [14,15,16,17,18,19,20].
4 Modelo hospedero-vector independientemente de las edades
Usando las siguientes tranformaciones
|
|
(8) |
y
|
|
(9) |
donde es el total de hospederos asintomáticos con cualquier edad de la infección asintomática y es el total de hospederos susceptibles de cualquier edad cronológica. Además, las funciones dependientes de alguna de las edades se definen como constantes, , , y . Al integrar la primera ecuación del sistema (1) con respecto de y la cuarta ecuación de (1) con respecto de utilizando las respectivas condiciones de frontera, el sistema integro-diferencial (1) se reduce a un modelo en ecuaciones diferenciales ordinarias para el virus de chikungunya que ha sido estudiado por Vázquez-Peña et al. [13]
|
|
(10) |
Considerando ambas poblaciones constantes y el sistema se reduce a
|
|
(11) |
Las condiciones iniciales del sistema (11) están dadas por
|
|
Donde e no son cero simultáneamente.
La región factible de las soluciones del modelo (11) es
|
|
4.1 Número Reproductivo Básico
Para calcular el número reproductivo básico, Vázquez-Peña et al. [13] utilizaron el método de la matriz de la siguiente generación [21]. Separaron las ecuaciones en , que contiene los términos asociados a nuevas infecciones, y , que incluye los términos de transiciones individuales en cada clase, es decir,
|
|
y
|
|
Tras calcular las matrices Jacobianas de y y evaluarlas en el punto de equilibrio libre de la enfermedad se obtienen, respectivamente, una matriz no negativa y una -matriz .
|
|
Entonces, el número reproductivo básico está dado por el radio espectral de la matriz , es decir
|
(12) |
donde
|
|
(13) |
denota el número promedios de casos secundarios que produce un individuo infectado al introducirlo a una población totalmente susceptible.
4.2 Puntos de equilibrio y su estabilidad global
Además del punto de equilibrio libre de la enfermedad , el modelo (11) tiene un punto de equilibrio endémico , con
|
|
(14) |
Dado que el sistema (11) es un caso particular del sistema integro-diferencial (2), obtenemos el siguiente corolario derivado del Teorema 1.
Corolario 1: i) Cuando entonces el punto de equilibrio libre de la enfermedad del sistema (11) es global asintóticamente estable. Cuando entonces el punto de equilibrio endémico del sistema (11) es global asintóticamente estable.
5 Estimación Bayesiana
5.1 Brote de chikungunya en Acapulco
En 2015, Acapulco, Guerrero, experimentó un brote de chikungunya. En [10] se realizó un estudio transversal para caracterizar dicho brote epidémico, que incluyó encuestas en 1,305 viviendas distribuidas en ocho conglomerados urbanos considerados representativos de Acapulco. En total, se administraron 5,870 cuestionarios, identificando 3,531 casos de chikungunya entre enero y diciembre de 2015.
Usando los datos recabados por [10] sobre los casos mensuales autorreportados de chikungunya, se ajustará la curva de los humanos infectados para estimar de manera puntual y por intervalo los parámetros y el número reproductivo básico del modelo (11).
Para reducir el impacto de las fluctuaciones aleatorias o ruido en los datos, se aplicará el modelo de suavizamiento exponencial:
|
|
|
|
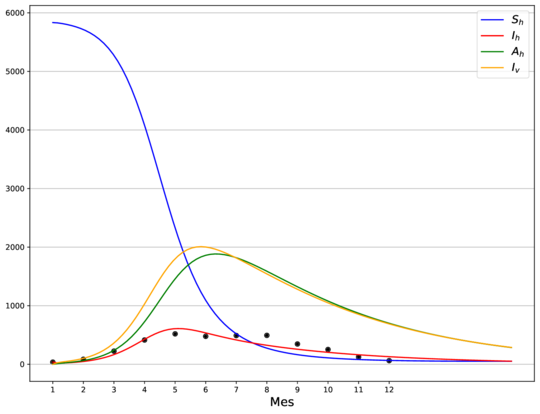
| (1) Modelo ajustado usando la media como estimador puntual. |
5.2 Modelo estadístico
Para , el vector de observaciones del número de humanos infectados () en el tiempo, considere el siguiente modelo estadístico:
|
|
(15) |
donde:
- es la variables respuesta del modelo y representa el número de humanos infectados () en el tiempo .
- es vector de parámetros en la estimación Bayesiana.
- es la solución numérica del modelo (11) con el método . En este caso se usó el método numérico de Runge-Kutta de orden 4.
- es el error aleatorio en el tiempo , los errores son independientes para cada tiempo, normalmente distribuidos con media cero y varianza .
5.3 Función de verosimilitud
Considerando el supuesto de normalidad , entonces se tiene que . Por tal razón, la función de verosimilitud de basada en está dada por la ecuación (16):
|
|
(16) |
5.4 Distribución a priori y a posteriori
La estadística Bayesiana permite incorporar información o conocimiento de los parámetros al proceso de inferencia, esta información la especifica el investigador por medio de una distribución previa, frecuentemente se le denomina distribución a priori y la denotamos por , la distribución a priori puede restringir la inferencia de los parámetros a un intervalo de interés y asignar mayor probabilidad un subconjunto de los valores. Para proponer la distribución a prior de se investigó en la literatura los valores que se han reportado y se muestran en la Tabla 1.
| Parámetro | Descripción | Referencia | Valor medio o rango de valores | Distribución a priori |
| Probabilidad de transmisión de vector a humano | [22] | 0.99 [0.6,1] | ||
| [23] | 0.37 | |||
| [24] | [0.5, 0.8] | |||
| [25] | 0.67 [0.26, 1] | |||
| Probabilidad de transmisión de humano a vector | [22] | 0.6 [0.6,1] | ||
| [23] | 0.375 | |||
| [24] | 0.37 | |||
| Número de picaduras | [22] | 2.46 [1,3] | ||
| [23] | 1 | |||
| [24] | 0.5 or 1 | |||
| Tasa de muerte y nacimiento de vectores | [23] | 2.72 | ||
| [24] | 4.28 | |||
| [26] | 2.14 | |||
| Tasa de recuperación | [22] | [3.7,4.5] | ||
| [26] | [2,6] | |||
| Fracción de infectados que se vuelven asintomáticos | Supuesto | |||
| Tasa de recaída | [8] | 0.5 | ||
| [10] | 0.66 | |||
| Fracción de transmisión de humano asintomático a vector | Supuesto | |||
| Número total de vectores | Supuesto | 2 a 4.5 veces el número total de humanos | ||
| Tasa de muerte y nacimiento de humanos | [27] | Valor fijo | ||
| Número total de humanos | [10] | 5870 | Valor fijo |
El resultado de la inferencia Bayesiana es la llamada distribución a posteriori, por el teorema de Bayes la distribución a posteriori esta definida por (17):
|
|
(17) |
donde
- es la probabilidad a posteriori de dada un conjunto de observaciones .
- es la probabilidad de las observaciones para un valor específico del vector .
- distribución a priori.
- es un constante de normalización .
Note que la expresión (17) esta bien definida si . es constante, por tanto podemos reescribir (17) como (18):
|
|
(18) |
En el proceso de inferencia, el objetivo es obtener analíticamente el valor medio de la distribución posterior de los parámetros. Para ello, es necesario marginalizar dicha distribución a posteriori.
|
|
(19) |
Sin embargo, en la gran mayoría de los casos, la integral de la marginalización (19) no puede resolverse de forma analítica debido a la alta dimensionalidad de . En la práctica, se utiliza el método de Markov Chain Monte Carlo (MCMC) para realizar un muestreo aproximado de los elementos que conforman el vector de parámetros [28]. El MCMC emplea muestreadores como el algoritmo de Metropolis-Hastings, el algoritmo t-walk, el muestreador de Gibbs y el Hamiltoniano Monte Carlo (HMC).
El método MCMC construye una cadena de Markov a partir de los valores muestreados. Cada estado de la cadena corresponde a un valor de la distribución objetivo, y cada iteración del muestreo genera un nuevo estado que depende del estado anterior. Este proceso estocástico iterativo se continúa hasta que la cadena muestra convergencia. Es común que durante un período inicial los valores muestreados estén alejados del valor verdadero, por lo que se recomienda descartar este período inicial. A este período se le conoce como “periodo de quemado”.
Una vez obtenida la muestra de los parámetros de interés, para realizar inferencias se utiliza el estimador de Bayes , definido como la solución de 20.
|
|
(20) |
con la función de pérdida cuadrática, se obtiene el mínimo en , es decir el estimador obtenido es el valor medio . Utilizamos este estimador para hacer inferencias en las densidades a posteriori.
Para la estimación por intervalo se utilizó el método de intervalos de alta densidad a posteriori (HPD, por sus siglas en inglés Highest Posterior Density). Se prefieren los intervalos HPD sobre el método de percentiles debido a que los HPD son los intervalos de menor longitud entre todos los posibles intervalos de probabilidad para un nivel de credibilidad deseado.
5.5 Método Hamiltoniano de Monte Carlo
El método de Hamiltoniano Monte Carlo (HMC) ha demostrado ser un muestreador más eficiente que los tradicionales. Su tasa de aceptación es aproximadamente el doble de la tasa de aceptación del algoritmo de Metropolis-Hastings [29]. Esta técnica de muestreo se basa en la mecánica Hamiltoniana para explorar distribuciones de alta dimensionalidad. El estudio detallado de esta técnica avanzada está fuera del alcance de este trabajo; para una comprensión más profunda de HMC, se recomienda consultar el trabajo de Betancourt [30].
5.6 Convergencia de Cadenas
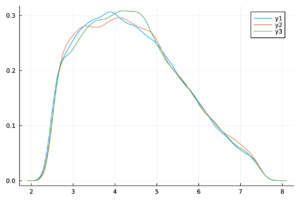
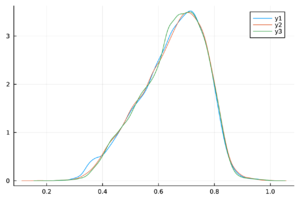
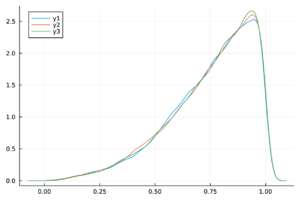
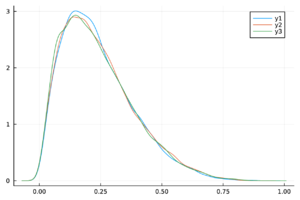
- Método de inspección visual: Este método se basa en la observación empírica de las cadenas de Markov para verificar que sus trazas estén adecuadamente mezcladas. Es común que esta mezcla produzca visualmente una figura similar a una “oruga”.
- Diagnóstico de Gelman-Rubin: Este diagnóstico es uno de los más populares para determinar la convergencia de las cadenas de Markov. Se basa en comparar la varianza dentro de las cadenas con la varianza entre cadenas utilizando el cociente [31]. En la práctica, se considera que las cadenas convergen si , mientras que si , al menos una de las cadenas aún no ha convergido.
5.7 Software estadístico
En este trabajo se utilizó el lenguaje de programación Julia [32] con el paquete de análisis Bayesiano Turing.jl [33] para estimar los parámetros. Se ejecutaron tres cadenas de Markov, cada una inicializada de manera aleatoria y con 20,000 iteraciones. Las primeras 1,000 iteraciones de cada cadena se descartaron como periodo de quemado, resultando en una muestra final de 19,000 valores por cadena. El diagnóstico de convergencia de Gelman-Rubin se realizó por defecto utilizando el paquete Turing.
Se utilizo la paquetería MCMChains.jl [34] para estimar los intervalos de HPD al 95%
6 Resultados
En la Tabla 2, se presentan los resultados de la estimación Bayesiana para los parámetros del modelo, así como para el número reproductivo básico . La Tabla 2 muestra los valores de media, mediana, intervalos de HPD del 95% y los valores de Rhat para cada parámetro.
Las probabilidades de transmisión de vector a humano y de humano a vector tienen medias de 0.72 y 0.75, respectivamente, con intervalos de credibilidad del 95% de (0.46, 0.97) y (0.49, 0.98). Esto representa probabilidades altas de transmisión.
El promedio del número de picaduras de los vectores es de 3.13, con un intervalo de credibilidad del 95% de (2.29, 4.00). La media de la tasa de muerte y nacimiento de vectores es de 3.41 , con un intervalo de credibilidad del 95% de (2.08, 4.44), lo que equivale a un periodo de vida de los vectores de 6.7 a 14.4 . Se estima una media del número total de vectores de 19,18, con un intervalo de credibilidad del 95% de (12,58, 26,35).
La tasa de recuperación tiene una media de 4.44, con un intervalo de credibilidad del 95% de (2.50, 6.63), lo que corresponde a un periodo de recuperación de 4.5 a 12 . La tasa de recaídas muestra una media de 0.75 , con un intervalo de credibilidad del 95% de (0.38, 1.00), lo que equivale a un periodo de recaída de 30 a 77.7 .
La media de la fracción de infectados que se vuelven asintomáticos es 0.65, con un intervalo de credibilidad del 95% que varía entre una fracción baja de 0.41 y una alta de 0.84. La media de la fracción de transmisión de humano asintomático a vector es 0.24, con un intervalo de credibilidad del 95% de (0.01, 0.52), que va de una fracción casi nula a moderada.
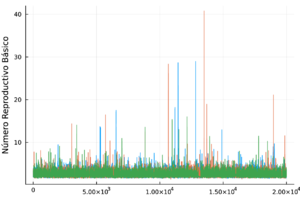
Finalmente, el número reproductivo básico fue de 2.61, con un intervalo de credibilidad del 95% de (1.66, 3.80). En [35] estiman que el es de 4.1 (intervalo de confianza del 95% de 1.5 a 6.6) para los vectores Aedes aegypti, lo que sugiere que el chikungunya podría propagarse rápidamente. Nuestras estimaciones son consistentes con lo publicado en [35].
En la Tabla 2 los valores de son menores a 1.1, por lo cual todas las cadenas presentadas son convergentes. Las trazas de los parámetros se muestran en la Tabla 3.
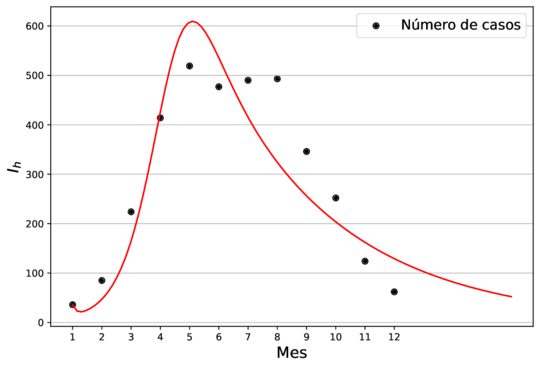
En la Figura 1 se muestra el ajuste del modelo a la curva de humanos infectados con chikungunya, así como la simulación de las cuatro clases: hospederos susceptibles , hospederos infectados , hospederos asintomáticos y vectores infectados . Los puntos sólidos representan los datos obtenidos por [10] que se han suavizado por el modelo de suavizamiento exponencial con .
| Parámetro | Media | Mediana | Intervalos de HPD del 95% | Rhat |
| 0.72 | 0.74 | (0.46, 0.97) | 1.00 | |
| 0.75 | 0.76 | (0.49, 0.98) | 1.00 | |
| 3.13 | 3.15 | (2.29, 4.00) | 1.00 | |
| 3.42 | 3.49 | (2.08, 4.44) | 1.00 | |
| 4.44 | 4.32 | (2.50, 6.63) | 1.00 | |
| 0.65 | 0.66 | (0.41, 0.84) | 1.00 | |
| 0.75 | 0.79 | (0.38, 1.00) | 1.00 | |
| 0.24 | 0.21 | (0.01, 0.52) | 1.00 | |
| 19183 | 19179 | (12589, 26358) | 1.00 | |
| 2.61 | 2.46 | (1.66, 3.80) | 1.00 |
|
| |||
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
7 Conclusiones
En este trabajo, presentamos una revisión de modelos recientemente desarrollados para el virus del chikungunya, uno de los cuales incorpora dos estructuras de edad y otro que es un caso particular, independiente de la edad.
La estimación de los parámetros del brote en Acapulco indica que la transmisión del virus es alta tanto de vectores a humanos como de humanos a vectores, sugiriendo un alto riesgo de propagación. El elevado número de picaduras contribuye a la propagación continua del virus. El número reproductivo básico () refuerza la capacidad del virus para expandirse rápidamente, siendo consistente con estudios previos que indican una rápida expansión del chikungunya. La fracción de transmisión de humanos asintomáticos a vectores varía de baja a moderada.
Estos resultados subrayan la importancia de implementar medidas de control y prevención efectivas para reducir la propagación del virus.
BIBLIOGRAFÍA
[1] Agusto, Folashade B and Easley, Shamise and Freeman, Kenneth and Thomas, Madison. (2016) "Mathematical model of three age-structured transmission dynamics of chikungunya virus", Volume 2016. Wiley Online Library. Computational and mathematical methods in medicine 1 4320514
[2] Vu, David M and Jungkind, Donald and LaBeaud, Angelle Desiree. (2017) "Chikungunya virus", Volume 37. Elsevier. Clinics in laboratory medicine 2 371–382
[3] Wahid, Braira and Ali, Amjad and Rafique, Shazia and Idrees, Muhammad. (2017) "Global expansion of chikungunya virus: mapping the 64-year history", Volume 58. Elsevier. International Journal of Infectious Diseases 69–76
[4] Rivera-Ávila, Roberto Carlos. (2014) "Fiebre chikungunya en México: caso confirmado y apuntes para la respuesta epidemiológica", Volume 56. SciELO Public Health. Salud pública de México 4 402–404
[5] Garay-Morán, Carolina and Román-Pedroza, Juan Francisco and López-Martínez, Irma and Rodríguez-Martínez, José Cruz and Ruiz-Matus, Cuitláhuac and Kuri-Morales, Pablo and Díaz-Quiñonez, José Alberto. (2017) "Caracterización clínica y epidemiológica de fiebre Chikungunya en México", Volume 41. SciELO Public Health. Revista Panamericana de Salud Pública e58
[6] Méndez, Nina and Baeza-Herrera, Luis and Ojeda-Baranda, Rafael and Huchim-Lara, Oswaldo and Gómez-Carro, Salvador. (2018) "Perfil clinicoepidemiológico de la infección por Chikungunya en casos hospitalarios atendidos en 2015 en Mérida, México", Volume 41. SciELO Public Health. Revista Panamericana de Salud Pública e91
[7] Simon, Fabrice and Javelle, Emilie and Oliver, Manuela and Leparc-Goffart, Isabelle and Marimoutou, Catherine. (2011) "Chikungunya virus infection", Volume 13. Springer. Current infectious disease reports 218–228
[8] Couturier, Elisabeth and Guillemin, Francis and Mura, Marie and Léon, Lucie and Virion, Jean-Marc and Letort, Marie-José and De Valk, Henriette and Simon, Fabrice and Vaillant, Véronique. (2012) "Impaired quality of life after Chikungunya virus infection: a 2-year follow-up study", Volume 51. Oxford University Press. Rheumatology 7 1315–1322
[9] Staikowsky, Frederik and Le Roux, Karin and Schuffenecker, Isabelle and Laurent, Philippe and Grivard, Philippe and Develay, A and Michault, Alain. (2008) "Retrospective survey of Chikungunya disease in Reunion Island hospital staff", Volume 136. Cambridge University Press. Epidemiology & Infection 2 196–206
[10] de La Cruz-Castro, Ixtac Xochitl and Nava-Aguilera, Elizabeth and Morales-Pérez, Arcadio and Betanzos-Reyes, Ángel Francisco and Flores-Moreno, Miguel and Morales-Nava, Liliana and Balanzar-Martínez, Alejandro and Serrano-de Los Santos, Felipe René and Andersson, Neil. (2020) "Factors associated with chikungunya relapse in Acapulco, Mexico: a cross-sectional study", Volume 20. Mary Ann Liebert, Inc., publishers 140 Huguenot Street, 3rd Floor New …. Vector-Borne and Zoonotic Diseases 10 782–787
[11] Mac, P. A. and Airiohuodion, P. E. and Velayudhan, R. and others. (2023) "Antibody seropositivity and endemicity of chikungunya and Zika viruses in Nigeria", Volume 3. Animal Diseases 7
[12] Vázquez-Peña, María Guadalupe and Vargas-De-León, Cruz and Velázquez-Castro, Jorge. (2024) "Global stability for a mosquito-borne disease model with continuous-time age-structure in the susceptible and relapsed host classes". Submitted to Mathematical Biosciences and Engineering
[13] Vázquez-Peña, María Guadalupe and Vargas-De-León, Cruz and Camacho-Pérez, Jorge Fernando and Velázquez-Castro, Jorge. (2023) "Analysis and Bayesian estimation of a model for Chikungunya dynamics with relapse: An outbreak in Acapulco, Mexico", Volume 20. Mathematical Biosciences and Engineering 10 18123–18145
[14] Korobeinikov, A. (2004) "Lyapunov functions and global properties for SEIR and SEIS epidemic models", Volume 21. Mathematical Medicine and Biology 2 75–83
[15] Korobeinikov, A. (2004) "Global properties of basic virus dynamics models", Volume 66. Bulletin of Mathematical Biology 4 879–883
[16] Vargas-De-León, C. and Castro-Hernández, J. A. (2008) "Local and global stability of host-vector disease models", Volume 25. Foro-Red-Mat: Revista Electrónica de Contenido Matemático 1–9
[17] Vargas-De-León, C. (2012) "Global analysis of a delayed vector-bias model for malaria transmission with incubation period in mosquitoes", Volume 9. Mathematical Biosciences and Engineering 1 165–174
[18] Vargas-De-León, Cruz. (2014) "On the global stability of infectious diseases models with relapse", Volume 9. Abstraction and Application Magazine
[19] Vargas-De-León, Cruz and Esteva, Lourdes and Korobeinikov, Andrei. (2014) "Age-dependency in host-vector models: The global analysis", Volume 243. Elsevier. Applied Mathematics and Computation 969–981
[20] Vargas-De-León, Cruz. (2016) "Global stability properties of age-dependent epidemic models with varying rates of recurrence", Volume 39. Wiley Online Library. Mathematical Methods in the Applied Sciences 8 2057–2064
[21] Van den Driessche, Pauline and Watmough, James. (2002) "Reproduction numbers and sub-threshold endemic equilibria for compartmental models of disease transmission", Volume 180. Elsevier. Mathematical biosciences 1-2 29–48
[22] Abboubakar, Hamadjam and Guidzavaï, Albert Kouchéré and Yangla, Joseph and Damakoa, Irépran and Mouangue, Ruben. (2021) "Mathematical modeling and projections of a vector-borne disease with optimal control strategies: A case study of the Chikungunya in Chad", Volume 150. Elsevier. Chaos, Solitons & Fractals 111197
[23] Dumont, Yves and Chiroleu, Frederic. (2010) "Vector control for the Chikungunya disease", Volume 7. Mathematical Biosciences & Engineering. Mathematical Biosciences & Engineering 2 313–345
[24] Dumont, Yves and Chiroleu, Frédéric and Domerg, Caroline. (2008) "On a temporal model for the Chikungunya disease: modeling, theory and numerics", Volume 213. Elsevier. Mathematical biosciences 1 80–91
[25] Ruiz-Moreno, Diego and Vargas, Irma Sanchez and Olson, Ken E and Harrington, Laura C. (2012) "Modeling dynamic introduction of Chikungunya virus in the United States", Volume 6. Public Library of Science San Francisco, USA. PLoS Neglected Tropical Diseases 11 e1918
[26] González-Parra, Gilberto C and Aranda, Diego F and Chen-Charpentier, Benito and Díaz-Rodríguez, Miguel and Castellanos, Jaime E. (2019) "Mathematical modeling and characterization of the spread of chikungunya in Colombia", Volume 24. MDPI. Mathematical and Computational Applications 1 6
[27] Consejo Nacional de Población. (2022) "Indicadores demográficos de México de 1950 a 2050 (Spanish) [National Population Council, Demographic Indicators of Mexico from 1950 to 2050]"
[28] Gelman, Andrew and Carlin, John B. and Stern, Hal S. and Rubin, Donald B. (1995) "Bayesian Data Analysis". Chapman and Hall/CRC
[29] Rodríguez-Parra, M. A. and Vargas-De-León, C. and Godinez-Jaimes, F. and Martinez-Lázaro, C. (2023) "Bayesian estimation of parameters in viral dynamics models with antiviral effect of interferons in a cell culture", Volume 20. Mathematical Biosciences and Engineering 11033–11062
[30] Betancourt, Michael. (2017) "A Conceptual Introduction to Hamiltonian Monte Carlo"
[31] Vehtari, Aki and Gelman, Andrew and Simpson, Daniel and Carpenter, Bob and Bürkner, Paul-Christian. (2021) "Rank-Normalization, Folding, and Localization: An Improved Rˆ for Assessing Convergence of MCMC (with Discussion)", Volume 16. Bayesian Analysis 1–70
[32] Bezanson, Jeff and Edelman, Alan and Karpinski, Stefan and Shah, Viral B. (2017) "Julia: A Fresh Approach to Numerical Computing", Volume 59. SIAM Review 65–98
[33] Ge, He and Xu, Kun and Ghahramani, Zoubin. (2018) "Turing: a language for flexible probabilistic inference". International Conference on Artificial Intelligence and Statistics. PMLR 1682–1690
[34] Cameron Pfiffer and David Widmann and Martin Trapp and Rob J Goedman and Michael Krabbe Borregaard and Rik Huijzer and Seth Axen and Hong Ge and Kai Xu and dfish and Tor Erlend Fjelde and Andreas Noack and PaulinaMartin96 and Chris Elrod and Jeremiah and Julia TagBot and Matt Karikomi and Hessam Mehr and Xianda Sun and Will Tebbutt. (2024) "TuringLang/MCMCChains.jl: v6.0.6", Volume v6.0.6. Zenodo
[35] Haider, N. and Vairo, F. and Ippolito, G. and Zumla, A. and Kock, R. A. (2020) "Basic reproduction number of Chikungunya virus transmitted by Aedes mosquitoes", Volume 26. Emerging Infectious Diseases 10 2429–2431
Document information
Published on 19/11/24
Submitted on 09/09/24
Licence: CC BY-NC-SA license
Share this document
Keywords
claim authorship
Are you one of the authors of this document?